Antibody Discovery / Scoperta di anticorpi
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
Discovering an antibody that specifically binds to that target and picking lead candidates.
Methods for discovering antibodies have gone through a massive transformation over the past few
decades, streamlining the quality with which fully humanized monoclonal antibodies are discovered
and tested.
The now “traditional” approaches to antibody discovery relied on the tedious generation of
hybridomas; a hybrid cell type formed when a primary antibody-producing cell is isolated from an animal and fused with a myeloma cell.
The process involved immunization of a model organism (usually a rodent), with the target recombinant
antigen.
Antibody-producing splenocytes are then harvested from immunized mice, and single
splenocytes producing a single antibody species are then fused with a continuously proliferating
myeloma cell line to generate a hybridoma that secretes the antibody candidate.
The first hybridomas were developed in 1975 to suggest a role in the pathology of using mice, and
the traditional process can lead to the identification of specific, high-affinity murine antibodies.
The first approved monoclonal antibody, Orthoclone OKT3, was made using this method. Since then, only three fully murine antibodies have been FDA approved, all of which have been discovered using the hybridoma method.
The reason for this low number of approved murine antibodies is that they face a
number of challenges, including the induction of a human anti-mouse antibody response (HAMA), which leads to rapid clearance of the mAb and can lead to allergic response and reduced efficacy
Humanizing the Mouse
Hybridoma technology has yielded the majority of FDA-approved therapeutic mAbs—49 out of 79—but only three are fully murine reflecting the need to overcome decreased efficacy due timmunogenicity
caused by the human anti-murine antibody (HAMA) response.
To deal with the challenges of HAMA, several strategies and technologies have been developed to transition murine mAbs into more humanized versions of themselves.
Traditional hybridoma technology can take anywhere from 3–6 months to generate a stable hybridoma cell line.
It may then take at least another 2 months to run functional assays.
This adds to development costs and lengthens timelines.
At Twist Biopharma, we complete the discovery process with our proprietary processes in 8 weeks.
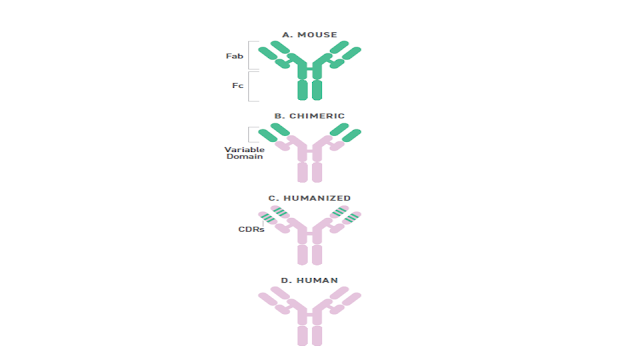
Chimeric and Humanized mAbs
High-affinity murine mAbs can be made more human using relatively straightforward cloning techniques.
It involves taking the DNA sequence from the murine heavy and light chain variable regions (VH and VL, respectively) and fusing them to the human heavy and light chain constant regions.
Essentially, this creates a mAb with a murine Fab fragment and a human Fc region—a chimera.
The first chimeric antibody Reopro (abciximab) an anti-GPIIb/IIIa antigen-binding fragment (Fab), was approved by the FDA in 1994 and there have been several other successful chimeric antibodies, including MabThera/Rituxan (rituximab), approved by the FDA in 1997 for the treatment of non-Hodgkin’s lymphoma (other indications have since been added to the label).
Another similar strategy for humanizing murine mAbs is by grafting murine CDRs into a human framework.
The strategy is similar to creating chimeric mAbs, but is more specific, using only the murine regions that are involved in antigen binding.
These humanized antibodies typically retain antigen binding function, without
the immunogenicity issues seen with fully murine or chimeric mAbs.
There may be a need for downstream engineering following CDR grafting of the human framework as other regions of the murine mAb, outside of the CDR, are involved in antigen binding.
This can typically be discovered through structural studies using X-ray crystallography or cryo-EM. Zinbryta (daclizumab), an anti-IL-2 receptor therapeutic, became the first humanized mAb to be approved by the FDA in 1997.
Fully Human mAbs From Transgenic Mice
With the success of chimeric and humanized mAbs, techniques for developing fully human mAbs soon
emerged.
In 1994, two transgenic mouse strains, the HuMabMouse and XenoMouse were created and used as the earliest in vivo-based technologies for developing fully human mAbs.
These strains were genetically modified to replace the endogenous mouse Ig genes with the human Ig genes.
These transgenic mice are capable of synthesizing fully human mAbs following immunization and, using the hybridoma technique, researchers are able to isolate target-specific mAbs.
An anti-epidermal growth factor receptor (EGFR) antibody Vectibix (panitumumab), became the first mAb purified from transgenic mice to be FDA-approved in 2006.
However, due to the presence of the human constant region, B cells were found not to compartmentalize efficiently in the natural B cell maturation process, therefore the next generation of transgenic mice using the murine constant region rectified this.
There are also now transgenic mice that produce chimeric antibodies, following immunization, with murine Fc and human Fab.
It therefore follows that the more efficient strains of transgenic mice generate chimeric
antibodies that can be fully humanized in a straightforward manner following identification of antigenpositive B cells.
These mice were created to overcome a specific challenge: HuMabMouse and XenoMouse
exhibit only very low levels of somatic hypermutation and human antibody generation, due to the lack of the murine constant region.
There are now several transgenic chimeric mouse lines available, but only one,
the VelocImmune mouse, has yielded FDA-approved mAbs—seven to be exact.
The first therapeutic mAb isolated using the VelocImmune mouse was Praluent (alirocumab), which gained FDA approval in 2015.
ITALIANO
Scoprire un anticorpo che si lega specificamente a quel target e scegliere i candidati principali.
I metodi per scoprire gli anticorpi hanno subito una massiccia trasformazione negli ultimi pochi
decenni, ottimizzando la qualità con cui vengono scoperti anticorpi monoclonali completamente umanizzati e testato.
Gli approcci ormai "tradizionali" alla scoperta degli anticorpi si basavano sulla noiosa generazione di
ibridomi; un tipo di cellula ibrido formato quando una cellula che produce anticorpi primari viene isolata da un animale e fusa con una cellula di mieloma.
Il processo prevedeva l'immunizzazione di un organismo modello (di solito un roditore), con l'antigene del bersaglio ricombinante.
Gli splenociti produttori di anticorpi vengono quindi raccolti da topi immunizzati ed i singoli
splenociti che producono una singola specie di anticorpo vengono quindi fusi con una proliferazione continua con una linea cellulare di mieloma per generare un ibridoma che secerne l'anticorpo candidato.
I primi ibridomi sono stati sviluppati nel 1975 per suggerire un ruolo nella patologia dell'uso di topi, e
il processo tradizionale può portare all'identificazione di anticorpi murini specifici ad alta affinità.
Il primo anticorpo monoclonale approvato, Orthoclone OKT3, è stato prodotto utilizzando questo metodo. Da allora, solo tre anticorpi completamente murini sono stati approvati dalla FDA, tutti scoperti utilizzando il metodo dell'ibridoma.
La ragione di questo basso numero di anticorpi murini approvati è che devono affrontare una
numero di sfide, inclusa l'induzione di una risposta anticorpale umana anti-topo (HAMA), che porta a una rapida eliminazione del mAb e può portare a una risposta allergica ed ad una ridotta efficacia
Umanizzare il topo
La tecnologia dell'ibridoma ha prodotto la maggior parte degli mAb terapeutici approvati dalla FDA - 49 su 79 - ma solo tre sono completamente murini, il che riflette la necessità di superare la ridotta efficacia dovuta alla timmunogenicità causato dalla risposta dell'anticorpo umano anti-murino (HAMA).
Per affrontare le sfide di HAMA, sono state sviluppate diverse strategie e tecnologie per la transizione di mAb murini in versioni più umanizzate di se stessi.
La tecnologia tradizionale di ibridoma può richiedere da 3 a 6 mesi per generare una linea cellulare di ibridoma stabile.
Potrebbero quindi essere necessari almeno altri 2 mesi per eseguire i test funzionali.
Ciò si aggiunge ai costi di sviluppo ed allunga i tempi.
In Twist Biopharma, completiamo il processo di scoperta con i nostri processi proprietari in 8 settimane.
mAbs chimerici e umanizzati
I mAb murini ad alta affinità possono essere resi più umani utilizzando tecniche di clonazione relativamente semplici.
Si tratta di prendere la sequenza del DNA dalle regioni variabili della catena pesante e leggera murine (rispettivamente VH e VL) e fonderle con le regioni costanti della catena pesante e leggera umana.
Essenzialmente, questo crea un mAb con un frammento Fab murino e una regione Fc umana, una chimera.
Il primo anticorpo chimerico Reopro (abciximab) un frammento legante l'antigene anti-GPIIb/IIIa (Fab), è stato approvato dalla FDA nel 1994 e ci sono stati molti altri anticorpi chimerici di successo, tra cui MabThera/Rituxan (rituximab), approvato dal FDA nel 1997 per il trattamento del linfoma non Hodgkin (altre indicazioni sono state poi aggiunte all'etichetta).
Un'altra strategia simile per umanizzare i mAb murini consiste nell'innesto di CDR murini in una struttura umana.
La strategia è simile alla creazione di mAb chimerici, ma è più specifica, utilizzando solo le regioni murine coinvolte nel legame con l'antigene.
Questi anticorpi umanizzati mantengono tipicamente la funzione di legame con l'antigene, senza
i problemi di immunogenicità osservati con mAbs completamente murini o chimerici.
Potrebbe essere necessario un ingegneria a valle dopo l'innesto di CDR della struttura umana poiché altre regioni del mAb murino, al di fuori del CDR, sono coinvolte nel legame con l'antigene.
Questo può essere scoperto in genere attraverso studi strutturali che utilizzano la cristallografia a raggi X o la crio-EM. Zinbryta (daclizumab), una terapia anti-recettore IL-2, è diventato il primo mAb umanizzato ad essere approvato dalla FDA nel 1997.
MAbs completamente umani da topi transgenici
Con il successo degli mAb chimerici e umanizzati, presto le tecniche per lo sviluppo di mAb completamente umani sono emerse.
Nel 1994, due ceppi di topi transgenici, HuMabMouse e XenoMouse sono stati creati e utilizzati come le prime tecnologie in vivo per lo sviluppo di mAb completamente umani.
Questi ceppi sono stati modificati geneticamente per sostituire i geni Ig endogeni di topo con i geni Ig umani.
Questi topi transgenici sono in grado di sintetizzare mAb completamente umani dopo l'immunizzazione e, utilizzando la tecnica dell'ibridoma, i ricercatori sono in grado di isolare mAb specifici per il bersaglio.
Un anticorpo anti-recettore del fattore di crescita epidermico (EGFR) Vectibix (panitumumab), è diventato il primo mAb purificato da topi transgenici ad essere approvato dalla FDA nel 2006.
Tuttavia, a causa della presenza della regione costante umana, è stato scoperto che le cellule B non si compartimentano in modo efficiente nel processo naturale di maturazione delle cellule B, quindi la prossima generazione di topi transgenici che utilizzano la regione costante murina ha corretto questo.
Ora ci sono anche topi transgenici che producono anticorpi chimerici, dopo immunizzazione, con Fc murino e Fab umano.
Ne consegue quindi che i ceppi più efficienti di topi transgenici generano chimerici
anticorpi che possono essere completamente umanizzati in modo semplice dopo l'identificazione dei linfociti B antigenici.
Questi topi sono stati creati per superare una sfida specifica: HuMabMouse e XenoMouse
mostrano solo livelli molto bassi di ipermutazione somatica e generazione di anticorpi umani, a causa della mancanza della regione della costante murina.
Ora sono disponibili diverse linee di topi chimerici transgenici, ma solo uno,
il topo VelocImmune, ha prodotto mAbs approvati dalla FDA, sette per l'esattezza.
Il primo mAb terapeutico isolato utilizzando il topo VelocImmune è stato Praluent (alirocumab), che ha ottenuto l'approvazione della FDA nel 2015.
Da:
https://f.hubspotusercontent40.net/hubfs/547446/Technology%20Networks/Landing%20Pages/Twist%20Bio/May%202021/eBook_Biopharma_AntbodyDiscoveryandDev_02APRIL21_Rev1.0_0.pdf?__hstc=8807082.44b0f6eac84be5818378483b36bfad3b.1601170002551.1621382061009.1622335921752.112&__hssc=8807082.2.1622335921752&__hsfp=2281083568&hsCtaTracking=ab6385e9-0a38-4af4-8bcb-bcc4108a5a59%7C5e7e8d79-eaee-44f7-a75d-3d5a2a4f479e



Commenti
Posta un commento