Record di estensione della durata della vita stabilito in cellule di lievito utilizzando un oscillatore genetico sintetico / Lifespan Extension Record Set In Yeast Cells Using Synthetic Gene Oscillator
Record di estensione della durata della vita stabilito in cellule di lievito utilizzando un oscillatore genetico sintetico / Lifespan Extension Record Set In Yeast Cells Using Synthetic Gene Oscillator
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
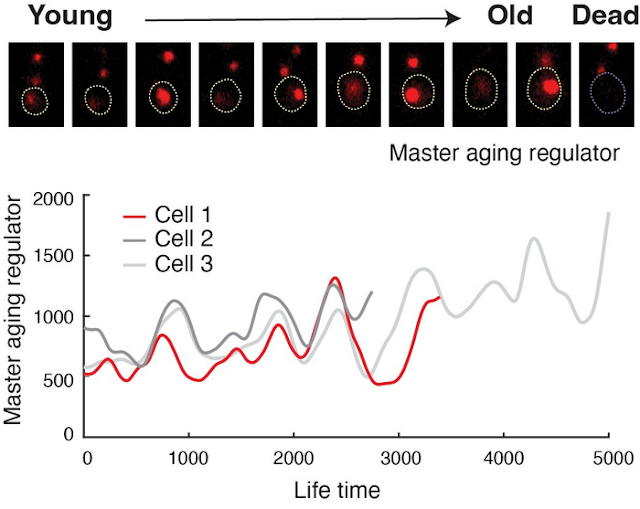
Un gruppo di scienziati dell'Università della California di San Diego (UCSD) ha ricablato geneticamente il circuito che controlla l'invecchiamento cellulare nel lievito. Dal suo ruolo normale che funziona come un interruttore a levetta, hanno progettato un ciclo di feedback negativo per bloccare il processo di invecchiamento cellulare. Il circuito ricablato funziona come un dispositivo simile ad un orologio, chiamato oscillatore genico, che spinge la cellula a passare periodicamente tra due stati "invecchiati" dannosi, evitando un impegno prolungato in uno dei due e quindi rallentando la degenerazione della cellula. Il loro approccio ha notevolmente esteso la durata della vita cellulare, stabilendo un nuovo record per l'estensione della vita attraverso interventi genetici e chimici.
I risultati rappresentano un esempio dimostrativo dell'utilizzo della biologia sintetica per riprogrammare il processo di invecchiamento cellulare. Dato che i percorsi di invecchiamento sottostanti sono conservati, i risultati potrebbero un giorno consentire la progettazione di circuiti genici sintetici che promuovono la longevità in organismi più complessi.
"Questa è la prima volta che la biologia sintetica guidata dal computer ed i principi ingegneristici sono stati utilizzati per riprogettare razionalmente i circuiti genici e riprogrammare il processo di invecchiamento per promuovere efficacemente la longevità", ha affermato Nan Hao, PhD, del Dipartimento di biologia molecolare della School of Biological Sciences, e co-direttore del Synthetic Biology Institute della UC San Diego.
Hao è l'autore senior dello studio pubblicato dal gruppo su Science , intitolato " Ingegneria della longevità: progettazione di un oscillatore genetico sintetico per rallentare l'invecchiamento cellulare ", in cui hanno concluso "I nostri risultati stabiliscono una connessione tra l'architettura della rete genica e la longevità cellulare che potrebbe portare a circuiti genici progettati razionalmente che rallentano l'invecchiamento.
La durata della vita umana è correlata all'invecchiamento delle nostre singole cellule e l'invecchiamento cellulare è un processo biologico fondamentale e complesso ed è un motore alla base di molte malattie. Le cellule, comprese quelle del lievito, delle piante, degli animali e dell'uomo, contengono tutte circuiti regolatori genici responsabili di molte funzioni fisiologiche, compreso l'invecchiamento. "Questi circuiti genetici possono funzionare come i nostri circuiti elettrici domestici che controllano dispositivi come elettrodomestici ed automobili", ha affermato Hao.
Tuttavia, il gruppo della UC San Diego aveva precedentemente scoperto che, sotto il controllo di un circuito di regolazione genica centrale, le cellule non invecchiano necessariamente allo stesso modo. Diversi anni fa il gruppo di ricerca ha iniziato a studiare i meccanismi alla base dell'invecchiamento cellulare. Usando il lievito Saccharomyces cerevisiae come modello per l'invecchiamento delle cellule umane, hanno scoperto che le cellule seguono una cascata di cambiamenti molecolari per tutta la loro vita fino a quando non degenerano e muoiono. Ma gli scienziati hanno notato che le cellule dello stesso materiale genetico ed all'interno dello stesso ambiente possono viaggiare lungo percorsi di invecchiamento distinti. Circa la metà delle cellule invecchia attraverso un graduale declino della stabilità del DNA, dove sono immagazzinate le informazioni genetiche. L'altra metà invecchia lungo un percorso legato al declino dei mitocondri, le unità di produzione di energia delle cellule.
Dopo aver identificato due direzioni distinte che le cellule seguono durante l'invecchiamento, i ricercatori hanno manipolato geneticamente questi processi per prolungare la durata della vita delle cellule. Per il loro lavoro recentemente riportato, il gruppo ha esteso la ricerca utilizzando la biologia sintetica per progettare un oscillatore genetico sintetico che impedisce alle cellule di raggiungere i normali livelli di deterioramento associati all'invecchiamento.
Immagina un'auto che invecchia con il deterioramento del motore o con l'usura della trasmissione, ma non entrambe le cose contemporaneamente. Il gruppo della UC San Diego ha immaginato un "processo di invecchiamento intelligente" che estende la longevità cellulare spostando il deterioramento da un meccanismo di invecchiamento ad un altro.
Come fanno spesso gli ingegneri elettrici, i ricercatori hanno prima utilizzato simulazioni al computer di come funziona il circuito di invecchiamento del nucleo. Questo li ha aiutati a progettare e testare le idee prima di costruire o modificare il circuito nella cella. Questo approccio ha vantaggi nel risparmiare tempo e risorse per identificare efficaci strategie di pro-longevità, rispetto alle strategie genetiche più tradizionali.
Per la ricerca ed i test utilizzando le cellule di lievito Saccharomyces cerevisiae, il gruppo ha sviluppato e utilizzato la microfluidica e la microscopia time-lapse per monitorare i processi di invecchiamento durante la vita della cellula. Per controllare l'invecchiamento nelle cellule di lievito, il gruppo ha manipolato l'espressione di due regolatori trascrizionali conservati: il regolatore dell'informazione silenziosa 2 (Sir2), che guida il declino nucleolare, e la proteina 4 dell'attivatore dell'eme (Hap4), che è associata alla biogenesi mitocondriale.
L'espressione di Sir2 e Hap4 sono collegate in quell'espressione di una repressione incrociata dell'altra. Il risultato è un interruttore a levetta trascrizionale presente in natura ed ampiamente conservato che guida le decisioni sul destino cellulare. Il lavoro recentemente riportato dagli autori descrive come hanno progettato un oscillatore genetico sintetico all'interno delle cellule di lievito che ricollega questo interruttore a levetta trascrizionale per generare oscillazioni sostenute tra i due stati di degenerazione cellulare nelle singole cellule. Creando un ciclo di feedback negativo nel circuito Sir2-HAP, l'oscillatore sintetico ritarda l'impegno del lievito verso uno dei due stati di deterioramento cellulare. "Queste oscillazioni hanno aumentato la durata della vita cellulare attraverso il ritardo dell'impegno all'invecchiamento derivante dalla perdita del silenziamento della cromatina o dall'esaurimento dell'eme".
Hanno scoperto che le cellule contenenti l'oscillatore del gene sintetico vivevano molto più a lungo delle cellule wild-type, mostrando un aumento dell'82% della durata della vita. "Questa è l'estensione della durata della vita più pronunciata nel lievito che abbiamo osservato con perturbazioni genetiche", ha osservato il team.
Durante il processo di ingegneria dei circuiti, i ricercatori hanno anche costruito e caratterizzato versioni del circuito sintetico con interazioni di feedback interrotte o indebolite. "Nessuno di questi circuiti ha consentito oscillazioni sostenute in una frazione importante di cellule, il che ha dimostrato l'importanza della connettività e la forza delle interazioni di feedback nella generazione di oscillazioni", hanno sottolineato.
Il nuovo risultato della biologia sintetica ha il potenziale per riconfigurare gli approcci scientifici al ritardo dell'età. Distinta dai numerosi tentativi chimici e genetici di forzare le cellule in stati artificiali di "giovinezza", la nuova ricerca fornisce la prova che è possibile rallentare i ticchettii dell'orologio dell'invecchiamento impedendo attivamente alle cellule di impegnarsi in un percorso predestinato di declino e morte, e gli oscillatori genici simili a orologi potrebbero essere un sistema universale per raggiungere questo obiettivo.
"Questa è la prima volta che la biologia sintetica guidata dal computer ed i principi ingegneristici sono stati utilizzati per riprogettare razionalmente i circuiti genici e riprogrammare il processo di invecchiamento per promuovere efficacemente la longevità", ha affermato Hao. “Le nostre cellule oscillatrici vivono più a lungo di qualsiasi dei ceppi più longevi precedentemente identificati da schermi genetici imparziali”.
I ricercatori hanno aggiunto: "I nostri risultati stabiliscono una connessione tra l'architettura della rete genica e la longevità cellulare che potrebbe portare a circuiti genici progettati razionalmente che rallentano l'invecchiamento... Il nostro lavoro rappresenta un esempio di prova del concetto, dimostrando l'applicazione riuscita della biologia sintetica per riprogrammare il processo di invecchiamento cellulare e può gettare le basi per la progettazione di circuiti genici sintetici per promuovere efficacemente la longevità in organismi più complessi”.
Il gruppo sta attualmente espandendo la propria ricerca sull'invecchiamento di diversi tipi di cellule umane, comprese le cellule staminali ed i neuroni.
In una prospettiva correlata, Howard Salis, PhD, presso la Pennsylvania State University, discute lo studio in modo più dettagliato. Ha notato che, come Hao et al., una strada per comprendere e controllare l'invecchiamento cellulare è misurare la dinamica dei percorsi che controllano la manutenzione e l'invecchiamento cellulare, sviluppare modelli a livello di sistema ed applicare l'analisi matematica per individuare ciò che chiama "il sintonizzabile manopole e fili intercambiabili” che possono essere manipolati per reindirizzare le dinamiche naturali di una cellula lontano dall'invecchiamento e verso il mantenimento di stati cellulari sani. “Combinando modelli a livello di sistema con sistemi genetici ingegnerizzati, si potrebbero sviluppare terapie candidate, ad esempio un inibitore di piccole molecole che allontani le dinamiche cellulari dagli stati disfunzionali o una strategia di combinazione che rimuova le cellule senescenti e le sostituisca con cellule migliorate attraverso ex terapia in vivo.
ENGLISH
A team of University of California San Diego (UCSD) scientists has genetically rewired the circuit that controls cell aging in yeast. From its normal role functioning like a toggle switch, they engineered a negative feedback loop to stall the cellular aging process. The rewired circuit operates as a clock-like device, called a gene oscillator, that drives the cell to periodically switch between two detrimental “aged” states, avoiding prolonged commitment to either and thereby slowing the cell’s degeneration. Their approach dramatically extended cellular lifespan, setting a new record for life extension through genetic and chemical interventions.
The findings represent a proof-of-concept example of using synthetic biology to reprogram the cellular aging process. Given that the underlying aging pathways are conserved, the findings may one day enable the design of synthetic gene circuits that promote longevity in more complex organisms.
“This is the first time computationally guided synthetic biology and engineering principles were used to rationally redesign gene circuits and reprogram the aging process to effectively promote longevity,” said Nan Hao, PhD, of the School of Biological Sciences’ Department of Molecular Biology, and co-director of UC San Diego’s Synthetic Biology Institute.
Hao is senior author of the group’s published study in Science, titled “Engineering longevity—design of a synthetic gene oscillator to slow cellular aging,” in which they concluded “Our results establish a connection between gene network architecture and cellular longevity that could lead to rationally designed gene circuits that slow aging.”
Human lifespan is related to the aging of our individual cells, and cellular aging is a fundamental and complex biological process and is an underlying driver for many diseases. Cells, including those of yeast, plants, animals and humans, all contain gene regulatory circuits that are responsible for many physiological functions, including aging. “These gene circuits can operate like our home electric circuits that control devices like appliances and automobiles,” said Hao.
However, the UC San Diego group had previously uncovered that, under the control of a central gene regulatory circuit, cells don’t necessarily age the same way. Several years ago the research team began studying the mechanisms behind cell aging. Using Saccharomyces cerevisiae yeast as a model for human cell aging, they discovered that cells follow a cascade of molecular changes through their entire lifespan until they eventually degenerate and die. But the scientists noticed that cells of the same genetic material and within the same environment can travel along distinct aging routes. About half of the cells age through a gradual decline in the stability of DNA, where genetic information is stored. The other half ages along a path tied to the decline of mitochondria, the energy production units of cells.
After identifying two distinct directions that cells follow during aging, the researchers genetically manipulated these processes to extend the lifespan of cells. For their newly reported work the team extended their research using synthetic biology to engineer a synthetic gene oscillator that keeps cells from reaching their normal levels of deterioration associated with aging.
Imagine a car that ages either as the engine deteriorates or as the transmission wears out, but not both at the same time. The UC San Diego team envisioned a “smart aging process” that extends cellular longevity by cycling deterioration from one aging mechanism to another.
As electrical engineers often do, the researchers first used computer simulations of how the core aging circuit operates. This helped them design and test ideas before building or modifying the circuit in the cell. This approach has advantages in saving time and resources to identify effective pro-longevity strategies, compared to more traditional genetic strategies.
For their research and tests using Saccharomyces cerevisiae yeast cells the team developed and employed microfluidics and time-lapse microscopy to track the aging processes across the cell’s lifespan. To control aging in the yeast cells the team manipulated the expression of two conserved transcriptional regulators: silent information regulator 2 (Sir2), which drives nucleolar decline, and heme activator protein 4 (Hap4), which is associated with mitochondrial biogenesis.
The expression of Sir2 and Hap4 are linked in that expression of one cross-represses the other. The result is a naturally occurring and widely conserved transcriptional toggle-switch that drives cellular fate decisions. The authors newly reported work describes how they engineered a synthetic gene oscillator within yeast cells that re-wires this transcriptional toggle switch to generate sustained oscillations between the two states of cellular degeneration in individual cells. By creating a negative feedback loop in the Sir2-HAP circuit, the synthetic oscillator delays the commitment of yeast to one of the two cellular deterioration states. “These oscillations increased cellular life span through the delay of the commitment to aging that resulted from either the loss of chromatin silencing or the depletion of heme.”
They found that cells containing the synthetic gene oscillator lived considerably longer than wild-type cells, exhibiting an 82% increase in lifespan. “This is the most pronounced life-span extension in yeast that we have observed with genetic perturbations,” the team noted.
During the process of circuit engineering the investigators also constructed and characterized versions of the synthetic circuit with broken or weakened feedback interactions. “None of these circuits enabled sustained oscillations in a major fraction of cells, which demonstrated the importance of connectivity and strength of feedback interactions in generating oscillations,” they pointed out.
The new synthetic biology achievement has the potential to reconfigure scientific approaches to age delay. Distinct from numerous chemical and genetic attempts to force cells into artificial states of “youth,” the new research provides evidence that slowing the ticks of the aging clock is possible by actively preventing cells from committing to a pre-destined path of decline and death, and the clock-like gene oscillators could be a universal system to achieve that.
“This is the first time computationally guided synthetic biology and engineering principles were used to rationally redesign gene circuits and reprogram the aging process to effectively promote longevity,” said Hao. “Our oscillator cells live longer than any of the longest-lived strains previously identified by unbiased genetic screens.”
The researchers added, “Our results establish a connection between gene network architecture and cellular longevity that could lead to rationally designed gene circuits that slow aging … Our work represents a proof-of-concept example, demonstrating the successful application of synthetic biology to reprogram the cellular aging process, and may lay the foundation for designing synthetic gene circuits to effectively promote longevity in more complex organisms.”
The team is currently expanding their research to the aging of diverse human cell types, including stem cells and neurons.
In a related Perspective, Howard Salis, PhD, at Pennsylvania State University, discusses the study in greater detail. He noted that, as Hao et al noted, one road to understanding and controlling cellular aging is to measure the dynamics of pathways that control cellular maintenance and aging, develop system-wide models, and apply mathematical analysis to pinpoint what he calls “the tunable knobs and swappable wires” that can be manipulated to redirect a cell’s natural dynamics away from aging and toward the maintenance of healthy cell states. “By combining system-wide models with engineered genetic systems, candidate therapeutics could be developed—for example, a small-molecule inhibitor that pushes cell dynamics away from dysfunctional states or a combination strategy that removes senescent cells and replaces them with improved cells through ex vivo therapy.” And reflecting on how the results may inform development of human therapeutics, Salis wrote, “If the collective objective of these interventions is to maintain healthier cell states, then the risk and morbidity of age-associated diseases will be reduced.”
Da:
https://www.genengnews.com/topics/translational-medicine/lifespan-extension-record-set-in-yeast-cells-using-synthetic-gene-oscillator/?MailingID=%DEPLOYMENTID%&utm_medium=newsletter&utm_source=GEN+Daily+News+Highlights&utm_content=01&utm_campaign=GEN+Daily+News+Highlights_20230428&oly_enc_id=8653B6936723E0S



Commenti
Posta un commento