Parkinson: individuato il punto in cui la proteina alfa-sinucleina diventa tossica. Scoperto un legame molecolare tra Parkinson e malattie prioniche / Parkinson's disease: identified where the alpha-synuclein protein becomes toxic. A molecular link between Parkinson's and prion diseases has been discovered
Parkinson: individuato il punto in cui la proteina alfa-sinucleina diventa tossica. Scoperto un legame molecolare tra Parkinson e malattie prioniche / Parkinson's disease: identified where the alpha-synuclein protein becomes toxic. A molecular link between Parkinson's and prion diseases has been discovered
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
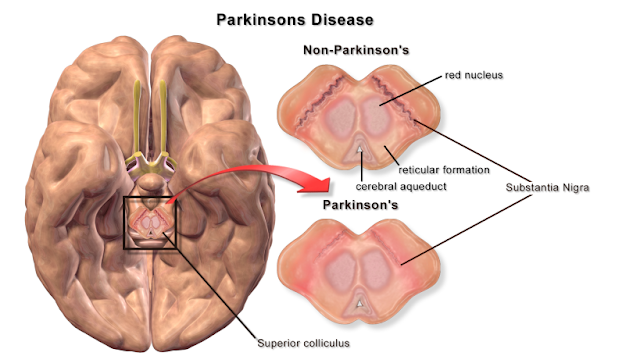
Il morbo di Parkinson è un disturbo cronico e progressivo del movimento che si ritiene essere innescato dalla morte delle cellule nervose, o neuroni, soprattutto all’interno di una regione del cervello chiamata substantia nigra, una zona chiave per il controllo del movimento.
Esattamente ciò che provoca la morte dei neuroni nel Parkinson non è chiaro, ma i ricercatori ipotizzano che una delle cause siano gli aggregati anomali della proteina alfa-sinucleina che si formano all’interno delle cellule nervose, noti anche come corpi di Lewy che sono considerati un segno distintivo del Parkinson.
I ricercatori spiegano che i corpi di Lewy nascono come risultato di una forma errata dell’alfa-sinucleina che la porta ad aderire ad altre proteine causando lo sviluppo di strutture simili a sottili filamenti noti come fibrille alfa-sinucleina.
I risultati del nuovo studio suggeriscono che la stessa proteina può causare o proteggere contro gli effetti tossici che portano alla morte delle cellule cerebrali, a seconda della sua forma strutturale specifica e che gli effetti tossici si sviluppano quando vi è uno squilibrio del livello della proteina nella sua forma naturale, in una cellula.
L’eccesso di proteina alfa-sinucleina solubile provoca la morte delle cellule cerebrali
Il team ha utilizzato tecniche ottiche a “super-risoluzione” per visionare dal vivo i neuroni dei ratti e verificare in che modo i neuroni rispondono a diverse forme di alfa-sinucleina, senza danneggiare il tessuto nervoso.
Quando le fibrille di alfa-sinucleina sono state introdotte nei neuroni, esse si sono collegate con la proteina alfa-sinucleina già presente nella cellula, senza produrre alcun effetto tossico.
Il morbo di Parkinson è un disturbo cronico e progressivo del movimento che si ritiene essere innescato dalla morte delle cellule nervose, o neuroni, soprattutto all’interno di una regione del cervello chiamata substantia nigra, una zona chiave per il controllo del movimento.
Esattamente ciò che provoca la morte dei neuroni nel Parkinson non è chiaro, ma i ricercatori ipotizzano che una delle cause siano gli aggregati anomali della proteina alfa-sinucleina che si formano all’interno delle cellule nervose, noti anche come corpi di Lewy che sono considerati un segno distintivo del Parkinson.
I ricercatori spiegano che i corpi di Lewy nascono come risultato di una forma errata dell’alfa-sinucleina che la porta ad aderire ad altre proteine causando lo sviluppo di strutture simili a sottili filamenti noti come fibrille alfa-sinucleina.
I risultati del nuovo studio suggeriscono che la stessa proteina può causare o proteggere contro gli effetti tossici che portano alla morte delle cellule cerebrali, a seconda della sua forma strutturale specifica e che gli effetti tossici si sviluppano quando vi è uno squilibrio del livello della proteina nella sua forma naturale, in una cellula.
L’eccesso di proteina alfa-sinucleina solubile provoca la morte delle cellule cerebrali
Il team ha utilizzato tecniche ottiche a “super-risoluzione” per visionare dal vivo i neuroni dei ratti e verificare in che modo i neuroni rispondono a diverse forme di alfa-sinucleina, senza danneggiare il tessuto nervoso.
Quando le fibrille di alfa-sinucleina sono state introdotte nei neuroni, esse si sono collegate con la proteina alfa-sinucleina già presente nella cellula, senza produrre alcun effetto tossico.
Tuttavia, i ricercatori hanno trovato che una forma solubile di alfa-sinucleina introdotta nei neuroni non interagisce con la proteina preesistente nella cellula e questo causa la morte delle cellule nervose.
“Così in qualche modo, la proteina solubile introdotta nei neuroni ha creato questo effetto tossico e il danno sembra essere visibile già prima della formazione delle fibrille”, spiega la Dr.ssa Pinotsi.
Successivamente, i ricercatori hanno introdotto sia la forma solubile di alfa-sinucleina che le fibrille di alfa-sinucleina, nei neuroni. Essi hanno scoperto che questa combinazione ha superato gli effetti tossici dovuti alla forma solubile di alfasinucleina; le fibrille hanno attratto le proteine solubili come magneti, secondo il team, ostacolando la loro tossicità.
Commentando i risultati, la Dr.ssa Pinotsi dice:
“Questi risultati cambiano il modo di considerare la malattia, perché il danno può verificarsi quando nei neuroni è semplicemente presente la forma solubile dell’alfa-sinucleina: è la quantità in eccesso di questa proteina che sembra causare gli effetti tossici che portano alla morte delle cellule cerebrali”.
Secondo gli autori, l’ eccesso della forma solubile di alfasinucleina può verificarsi a causa di fattori genetici o invecchiamento, sebbene studi precedenti hanno suggerito che anche un trauma cranico può essere una causa.
Negli Stati Uniti, più di 1 milione di persone vivono con la malattia di Parkinson. I sintomi includono tremori involontari, mobilità ridotta, disturbi dell’equilibrio e rigidità degli arti e del tronco.
Allo stato attuale, non esiste una cura per la malattia. Gli attuali trattamenti aiutano i pazienti a gestire i sintomi piuttosto che affrontare la condizione alla radice.
Ma secondo la Dr.ssa Pinotsi e colleghi, i loro risultati potrebbero aprire la porta a nuove strategie per prevenire oltre al Parkinson, anche altre malattie neurodegenerative che coinvolgono aggregati proteici anomali, come ad esempio il morbo di Alzheimer.
“Con queste tecniche ottiche a super-risoluzione, possiamo realmente vedere i dettagli che non abbiamo potuto vedere prima, quindi potremmo essere in grado di contrastare questo effetto tossico in una fase iniziale”, conclude la ricercatrice.
La malattia di Parkinson e le malattie prioniche sono molto diverse per quanto riguarda le origini e il corso. Tuttavia, un gruppo di ricerca di SISSA, guidato dal Professor Giuseppe Legname, ha scoperto un legame inaspettato e importante tra le due patologie.
Secondo lo studio, recentemente pubblicato nella rivista Scientific Reports, le due patologie sono legate dall’interazione complessa tra due proteine presenti nelle cellule nervose: la cosiddetta α-sinucleinanella sua forma aggregata e la prion proteina PrPC, la molecola responsabile, nella versione modificata, di gravi sindromi come la malattia di Creutzfeldt-Jakob.
La presenza di depositi di α-sinuclein nelle cellule cerebrali è tipica delle malattie chiamate sinucleinopatie, che includono la malattia di Parkinson, caratterizzata da demenza con corpi di Lewy e atrofia multipla del sistema. Tuttavia, le modalità secondo cui questi aggregati si formano e si diffondono sono fino ad ora sconosciuti.
Questi ricercatori hanno scoperto che la α-sinucleina utilizza effettivamente l’azione della proteina prionica per diffondersi e depositarsi nel cervello. Questo sembra favorire la formazione di questi depositi e la loro diffusione tra le cellule cerebrali .
Inoltre, mentre l’attività della proteina prionica sembra sostenere lo sviluppo delle sinucleopatie, i depositi di α-sinucleina sembrano allentare il corso delle malattie prioniche.
Infatti, questa ricerca ha dimostrato che fibrille α-synuclein bloccano il deposito di prioni nelle cellule nervose, impedendo così la loro replicazione. Questo effetto sorprendente è corroborato da ulteriori prove già riscontrate nella patologia, infatti il corso della malattia è più lento nei pazienti affetti da malattie prioniche che presentano depositi di α-sinucleina nelle cellule nervose.
ENGLISH
Researchers are increasingly closer to unraveling the causes of Parkinson's disease, having identified the point where the alpha-synuclein protein - a protein that plays a key role in the condition - becomes toxic to the brain.The first author of the study, Dr. Dorothea Pinotsi of the Department of Chemical Engineering and Biotechnology and Department of Chemistry at the University of Cambridge and colleagues, published their findings in the Proceedings of the National Academy of Sciences.
Parkinson's is a chronic and progressive movement disorder believed to be triggered by the death of nerve cells, or neurons, especially within a brain region called the substantia nigra, a key area for motion control.
Exactly what causes neurons to die in Parkinson's is unclear, but the researchers hypothesize that one of the causes is the abnormal aggregates of the alpha-synuclein protein that are formed inside nerve cells, also known as Lewy bodies that are considered a hallmark of Parkinson's.
The researchers explain that Lewy's bodies are born as a result of a wrong form of alpha-synuclein that leads her to adhere to other proteins causing the development of thin filament-like structures known as alpha-synuclein fibrils.
The results of the new study suggest that the same protein may cause or protect against the toxic effects that lead to brain cell death, depending on its specific structural form and that toxic effects develop when there is an imbalance of the protein level in the its natural form, in a cell.
The excess of soluble alpha-synuclein protein causes brain cell death
The team used "super-resolution" optical techniques to view rats' neurons live and see how neurons respond to different forms of alpha-synuclein without damaging nerve tissue.
When the alpha-synuclein fibrils were introduced into the neurons, they connected with the alpha-synuclein protein already present in the cell, without producing any toxic effect.
Researchers are increasingly closer to unraveling the causes of Parkinson's disease, having identified the point where the alpha-synuclein protein - a protein that plays a key role in the condition - becomes toxic to the brain.The first author of the study, Dr. Dorothea Pinotsi of the Department of Chemical Engineering and Biotechnology and Department of Chemistry at the University of Cambridge and colleagues, published their findings in the Proceedings of the National Academy of Sciences.
Parkinson's is a chronic and progressive movement disorder believed to be triggered by the death of nerve cells, or neurons, especially within a brain region called the substantia nigra, a key area for motion control.
Exactly what causes neurons to die in Parkinson's is unclear, but the researchers hypothesize that one of the causes is the abnormal aggregates of the alpha-synuclein protein that are formed inside nerve cells, also known as Lewy bodies that are considered a hallmark of Parkinson's.
The researchers explain that Lewy's bodies are born as a result of a wrong form of alpha-synuclein that leads her to adhere to other proteins causing the development of thin filament-like structures known as alpha-synuclein fibrils.
The results of the new study suggest that the same protein may cause or protect against the toxic effects that lead to brain cell death, depending on its specific structural form and that toxic effects develop when there is an imbalance of the protein level in the its natural form, in a cell.
The excess of soluble alpha-synuclein protein causes brain cell death
The team used "super-resolution" optical techniques to view rats' neurons live and see how neurons respond to different forms of alpha-synuclein without damaging nerve tissue.
When the alpha-synuclein fibrils were introduced into the neurons, they connected with the alpha-synuclein protein already present in the cell, without producing any toxic effect.
However, the researchers found that a soluble form of alpha-synuclein introduced into neurons does not interact with the pre-existing protein in the cell and this causes nerve cell death.
"So somehow, the soluble protein introduced into neurons has created this toxic effect and the damage seems to be visible even before fibril formation," explains Dr. Pinotsi.
Subsequently, the researchers introduced both the soluble form of alpha-synuclein and the fibrils of alpha-synuclein, in neurons. They found that this combination exceeded the toxic effects due to the soluble form of alfasinuclein; fibrils have attracted soluble proteins such as magnets, according to the team, hindering their toxicity.
Commenting on the results, Dr. Pinotsi says:
"These results change the way we consider the disease, because the damage can occur when the soluble form of alpha-synuclein is simply present in neurons: it is the excess amount of this protein that seems to cause the toxic effects that lead to the death of brain cells ".
According to the authors, the excess soluble form of alfasinuclein may occur due to genetic factors or aging, although previous studies have suggested that even a head injury may be a cause.
In the United States, more than 1 million people live with Parkinson's disease. Symptoms include involuntary tremors, reduced mobility, balance disorders and stiffness of the limbs and trunk.
At present, there is no cure for the disease. Current treatments help patients manage symptoms rather than address the root condition.
But according to Dr. Pinotsi and colleagues, their results could open the door to new strategies to prevent, in addition to Parkinson's disease, other neurodegenerative diseases that involve abnormal protein aggregates, such as Alzheimer's disease.
"With these super-resolution optical techniques, we can really see the details we could not see before, so we might be able to counteract this toxic effect at an early stage," concludes the researcher.
Parkinson's disease and prion diseases are very different as regards the origins and the course. However, a SISSA research group led by Professor Giuseppe Legname discovered an unexpected and important link between the two pathologies.
According to the study, recently published in the journal Scientific Reports, the two pathologies are linked by the complex interaction between two proteins present in nerve cells: the so-called α-sinucleinanella its aggregate form and the prion protein PrPC, the molecule responsible, in the version modified, serious syndromes such as Creutzfeldt-Jakob disease.
The presence of α-sinuclein deposits in brain cells is typical of diseases called sinucleinopathies, which include Parkinson's disease, characterized by dementia with Lewy bodies and multiple system atrophy. However, the ways in which these aggregates are formed and spread are hitherto unknown.
These researchers found that α-synuclein actually uses the action of the prion protein to spread and settle in the brain. This seems to favor the formation of these deposits and their spread among the brain cells.
Furthermore, while the activity of the prion protein seems to support the development of sinucleopathies, α-synuclein deposits seem to loosen the course of prion diseases.
In fact, this research has shown that α-synuclein fibrils block the deposition of prions in nerve cells, thus preventing their replication. This surprising effect is corroborated by further evidence already found in the pathology, in fact the course of the disease is slower in patients suffering from prion diseases that have deposits of α-synuclein in nerve cells.
Da:
https://www.medimagazine.it/scoperto-un-legame-molecolare-parkinson-malattie-prioniche/
https://www.medimagazine.it/parkinson-individuato-il-punto-in-cui-la-proteina-alfa-sinucleina-diventa-tossica/



Commenti
Posta un commento