‘I feel so much hope’—Is a new drug keeping this woman’s deadly Huntington disease at bay? / "Sento tanta speranza": è un nuovo farmaco che tiene a bada la mortale malattia di Huntington?
‘I feel so much hope’—Is a new drug keeping this
woman’s deadly Huntington disease at bay? / "Sento tanta
speranza": è un nuovo farmaco che tiene a bada la mortale malattia di
Huntington?
Segnalato dal Dott. Giuseppe Cotellessa
/ Reported by Dr. Giuseppe Cotellessa
The dark shadow
of Huntington disease fell squarely over Michelle Dardengo’s life on the
day in 1986 that her 52-year-old father was found floating in the river in
Tahsis, the remote Vancouver Island mill town where she grew up. Richard Varney
had left his wedding ring, watch, and wallet on the bathroom counter; ridden
his bike to a bridge that spans the rocky river; and jumped. The 4.5-meter drop
broke his pelvis. The town doctor happened to be fishing below and pulled
Varney out as he floated downstream, saving his life.
But his tailspin
continued. The once funny man who read the Encyclopedia Britannica for
pleasure; the good dancer who loved ABBA, the Three Tenors, and AC/DC; the
affable volunteer firefighter—that man was disappearing. He was being replaced
by an erratic, raging misanthrope wedded to 40-ounce bottles of Bacardi whose
legs would not stay still when he reclined in his La-Z-Boy.
In 1988, Varney
was diagnosed with Huntington disease. That explained his transformation but
offered little comfort. Huntington is a brutal brain malady caused by a mutant
protein that inexorably robs victims of control of their movements and their
minds. Patients are plagued by jerky, purposeless movements called chorea. They
may become depressed, irritable, and impulsive. They inevitably suffer from
progressive dementia. The slow decline typically begins in midlife and lasts 15
to 20 years, as the toxic protein damages and finally kills neurons. For both
families and the afflicted, the descent is agonizing, not least because each
child of an affected person has a 50% chance of inheriting the fatal disease.
In the United
States, about 30,000 people have symptomatic Huntington disease and more than
200,000 carry the mutation that ensures they will develop it. Globally, between
three and 10 people in every 100,000 are affected, with those of European
extraction at highest risk. In a large study published in the Journal
of Neurology in June, Danish researchers found that people with
Huntington disease were nearly nine times more likely to attempt suicide than
the general population.
For the first 15
years after her father’s diagnosis, while scientists discovered the genetic
mutation that causes Huntington and embarked on a seemingly endless chase for a
remedy, Dardengo avoided the genetic testing that would reveal whether her
father’s decline was a preview of her future. Already married when her dad was
diagnosed, she gave birth to a son and a daughter and had a job she loved,
doing software diagnostics for an insurance company. Then in 2003, the year her
father died after being institutionalized for more than a decade, she got
tested. “It was bothering me,” she says. “You have to plan for the future.” She
was positive for the mutation.
About a decade
later, Dardengo noticed that her handwriting was becoming “unmanageable.” Her
balance declined. She returned from walking her dogs with bloody knees and
scraped hands. In April 2015—at 52, the same age that her father had leapt from
the bridge—she was forced to leave her job. “Cognitively, I don’t think you are
a good fit,” a new boss told her.
Then an
unfamiliar commodity entered her life: hope. Dardengo’s physician, Blair
Leavitt, a Huntington disease researcher at the University of British Columbia
(UBC) here, asked whether she wanted to join a nascent clinical trial of a new
medication made by a Carlsbad, California, biotechnology company, Ionis
Pharmaceuticals. The drug, the product of 25 years of research, was an
antisense molecule—a short stretch of synthetic DNA tailor-made to block
production of the Huntington protein.
Joining the
trial would be risky. Dozens of antisense drugs had entered clinical trials;
few had become approved drugs. This particular medicine, injected into the
fluid that surrounds the spinal cord, had never been put in humans. Dardengo
might receive the active drug or she might get a placebo. In August 2015, she
became “patient one."
Dardengo’s
father, shown holding her son Joel in a 1989 photo, died of Huntington disease.
Joel carries the mutation.
Three years
later, that trial is famous. Its results electrified the Huntington disease
community in December 2017 by indicating that the drug, formerly IONIS-HTTRx
and now called RG6042, reduces the amount of the culprit protein in the human
brain—the first time any medicine has done so. Preliminary data released in
April even hint at improvements in a few clinical measures.
The Basel,
Switzerland–based pharmaceutical company Roche, which licensed RG6042, is
preparing to move it into a pivotal clinical trial, with details to be
announced in the next few months. “We had emails and phone calls from patients
saying, ‘I want to join this [upcoming] trial now. I’m willing to move house to
do it,’” recalls Anne Rosser, a neuroscientist at Cardiff University, who
oversaw one of nine sites in the first trial.
She and others
who work with Huntington patients find themselves scrambling to manage
expectations. “One feels for these patients because the clock is ticking for
them,” Rosser says. But although the drug scored high for safety in the recent
trial, whether it slows or stops the disease simply isn’t known. “We haven’t
got evidence of efficacy,” she says. That will have to wait for the results of
the next trial. And some scientists still worry about the drug’s long-term
safety.
Given the
desperation of patients and their families, Louise Vetter, president and CEO of
the Huntington’s Disease Society of America in New York City, says her group
and others “need to manage back the hope a little bit. And that’s really hard.”
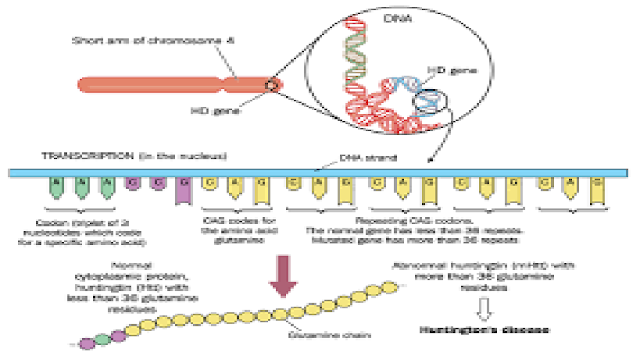
The mutation
that causes Huntington—named after U.S. physician George Huntington, who
described the disease in 1872—is located near the tip of the short arm of
chromosome 4. Healthy people carry two copies of the huntingtin gene, each with
up to 35 repetitions of a trio of nucleotides—cytosine, adenine, and guanine
(CAG). In the mutated gene, this CAG triplet is repeated 36 or more times, like
a stutter. People who inherit a copy of the mutant gene from one parent produce
a mutant huntingtin protein with an extra-long chain of glutamine amino acids.
No one is sure
just how the mutant protein damages neurons. But chains of glutamine longer
than 36 amino acids are much more likely to stick to each other, forming clumps
that may disrupt membranes or bind and inactivate other molecules within
neurons. Afflicted people produce mutant huntingtin throughout their lives, and
the damage mounts until symptoms appear. The more CAG repeats a patient
harbors, the sooner the inevitable day comes.
Regardless of
how the destruction happens, scientists reasoned, stopping production of the
mutant protein at its source should halt downstream damage. Back in 1992, Science declared
antisense technology one of the 10 hottest areas of the year; 1 year later, the
mutation that causes Huntington was published. Because just a single gene was
responsible, shutting it down with antisense seemed an obvious approach for a
therapy. The idea was that synthetic DNA snippets with a sequence complementary
to part of the huntingtin gene’s messenger RNA (mRNA) would bind to the mRNA.
In this case, the resulting DNA-mRNA complex summons a cutting enzyme, RNase H,
that degrades the mRNA and prevents its translation into protein.
But for 25 years
the idea wasn’t practical. Early antisense oligonucleotides (ASOs) didn’t bind
mRNA targets efficiently and were quickly degraded by enzymes. Several
companies dropped out. By the early 2000s, having chemically improved the ASOs
and done animal studies, Ionis began to tailor ASOs to specific neurological
diseases, including one to curb spinal muscular atrophy.
In 2006, Ionis
researchers, led by the firm’s vice president of research, Frank Bennett,
launched a collaboration with neuroscientist Don Cleveland and postdoc Holly
Kordasiewicz of the University of California, San Diego, to develop an ASO to
attack Huntington disease. (Kordasiewicz has since joined Ionis.) By 2012, they
had a 20-letter ASO that reversed symptoms and slowed brain atrophy in mouse
models of Huntington. In macaques, dogs, and pigs, the researchers injected the
ASO into the cerebrospinal fluid (CSF), which bathes the spinal cord and brain.
The drug reduced the mutant protein in key brain regions, including the cortex
and the corpus striatum, a deeper brain structure that is the disease’s first
target. And it appeared to be safe.
In early 2015,
researchers at several institutions delivered the last tool needed for a human
trial: new tests that could detect levels of mutant huntingtin protein in the
CSF. Crucially, one group also showed that in mice, reductions of mutant
protein in the CSF corresponded to reductions in the brain itself. Now,
researchers could collect human CSF and see reflected there how their ASO
likely affected levels of the toxic protein in patients’ brains.
In August 2015,
Dardengo lay on her side at UBC Hospital, her face to the wall. She felt
Leavitt’s needle inject anesthetic in the small of her back. After that, she
felt nothing while he withdrew 20 milliliters of her spinal fluid and replaced
it with the medication, dissolved in liquid. That was the first of four monthly
injections. The trial was double-blind: Neither she nor Leavitt knew whether
she was receiving placebo or the lowest of the planned doses of active drug,
the only dose given to the first subjects.
Dardengo was
unfazed by being patient one. “I never felt afraid,” she recalls. “Dr. Leavitt
always asked: ‘You know that you could die doing this?’ I always said: ‘Yes,
but my kids aren’t going to have to worry.’”
She thought she
felt better after the last monthly injection, but she saw no improvement in her
symptoms. Her balance was still off—she didn’t dare wear high heels—and she
still got stuck in the middle of sentences. Months earlier, she had quit
clipping her cat’s claws for fear of injuring the animal. Her husband Marc
Dardengo had stopped asking her to run errands for his business because she so
often got lost. These things didn’t change.
Then in November
2016, she and Marc received news that left them numb. Joel Dardengo, age 27,
told his parents he had been tested for the Huntington mutation. He was positive.
His mother’s
trial was cold comfort for Joel, a realist keenly aware of the pitfalls of
science. “You can YouTube the disease and see what the endgame looks like,” he
says. “It’s not the nicest.”
Joel told his
fiancée that she was free to leave him. She refused. The couple, who want to
have children, began to discuss in vitro fertilization, which would allow them
to implant only Huntington-free embryos. But Joel, an electronics technician,
and his fiancée, a prison guard, see no way to pay for the $30,000 procedure.
Thirteen months
later, at 12:01 a.m. on 11 December 2017, Michelle received an email: Ionis had
announced the results of the trial in a press release. (A paper is still in the
works.) After testing in 46 people, including her, RG6042 appeared to be safe,
with minimal side effects. And after four monthly doses, levels of mutant huntingtin in
patients’ CSF had decreased in a dose-dependent manner: The antisense molecule
appeared to be hitting its target.
The results
triggered a happy uproar among Huntington families. Michelle and Marc Dardengo
uncorked a bottle of chardonnay and toasted the possibility that their children
would live Huntington-free lives. Vetter, 5000 kilometers away, got a text
message from her scientific director telling her to check her email
immediately. She pulled over to the side of New Jersey’s Route 23, read the
Ionis press release, and wept. At Huntington disease clinics from Baltimore,
Maryland, to Bochum, Germany, phones began buzzing, email inboxes overflowing,
and appointment requests surging. At University College London, home to the
trial’s global leader, neurologist Sarah Tabrizi, patient referrals briefly
quadrupled.
On the same day
the results were revealed, Roche announced it had paid $45 million to license
the drug from Ionis and would move it into a pivotal clinical trial. That trial
will enroll hundreds of patients in Europe, Canada, and the United States for
up to 2 years, allowing the company to determine whether RG6042 slows or stops
the disease.
Ionis presented
more details about the first trial’s results at two meetings earlier this year.
In March, the company reported that levels of mutant protein in the two
highest-dose patient groups had declined on average by 40% and in some cases up
to 60%. (In lab animals, smaller reductions had reduced symptoms of the
disease.) And in April, Tabrizi reported that aggregated data from all patients
showed statistically significant improvement in three of five clinical measures
of Huntington disease progression, including tests of both motor and cognitive
function.
But researchers
were quick to temper the resulting excitement with caution. Bennett notes that
other clinical measures did not improve significantly. “You can always find
some correlations if you look hard enough. … The only way to really validate
this is to do additional longer-term studies.”
Tabrizi, who
like Leavitt consults for Roche and competing companies, agrees. She points out
that the first trial wasn’t designed to gauge effectiveness. “The big question
we have now is: Is the degree of mutant huntingtin lowering in
the brain enough to slow the disease’s progression?”
At the moment,
no one can say whether reduced protein levels will help already damaged brains
recover, how long any positive effects might last, or whether dangerous side
effects will crop up down the road. Tabrizi says patients should not expect
“some Lazarus-like effect.”
One scientist
not involved with the trial is even more circumspect. “People said in 1993: ‘We
have the gene—we have the cure,’” recalls Ole Isacson, a neurodegenerative
disease expert at the Harvard Stem Cell Institute. In the mid-1990s, he ran a
first, failed experiment trying to suppress huntingtin production
in mice using an ASO. “And 25 years later, there may be a slight chance. This
is not a sure home run.
Although the
first trial appeared to show that RG6042 is safe, some researchers still have
concerns because the drug suppresses production of both the normal and mutant
forms of the huntingtin protein. Because mutant huntingtin genes
vary in sequence, a drug targeted to one version of the mutant allele would not
work for every patient. It also would be technically more challenging to
develop. So Ionis opted for a nonselective ASO that targets a sequence found in
all huntingtin genes, mutant and normal.
Doing so was a
calculated risk. No one knows whether normal huntingtin is
essential to brain health in adults. (It is essential to early development:
Mice without it perish as embryos.) Bennett notes that RG6042’s effects are
less drastic than deleting the gene entirely: “We’re not knocking out huntingtin [protein],
we’re reducing it.” Leavitt shares his confidence, noting that in Ionis’s
in-house work, “Nothing from the preclinical animal studies suggested any
toxicity.”
But 1 year ago,
scientists at The University of Tennessee Health Science Center (UTHSC) in
Memphis found something different, as they reported in PLOS Genetics.
They knocked out the huntingtin protein in mice at 3, 6, and 9
months of age. At all ages, the mice developed severe motor and behavioral
deficits and progressive brain pathology: The animals’ thalami—sensory and
motor signal relay stations—became calcified, and their brains atrophied.
“We end up
sounding like a Cassandra,” says Paula Dietrich, a neurobiologist at UTHSC who
was the paper’s first author. “We bring the bad news, and nobody wants to hear
or believe it.”
Dietrich
concedes that mice findings may not apply to humans. But she notes that huntingtin is
expressed throughout the brain and cautions that the levels of RG6042 needed to
penetrate the deeper structures where Huntington pathology begins could have
unwanted effects. “To reach efficacy in the striatum, you may have to expose
other regions of the brain to extremely high concentrations,” she says.
Another company,
Wave Life Sciences of Cambridge, Massachusetts, is developing two antisense
drugs aimed at suppressing only the mutant gene, leaving the normal one
untouched. Wave’s ASOs target two sequence variants, one or both of which occur
in 70% of Huntington patients. Both drugs are in initial clinical trials, with
results expected next summer, and the firm thinks its approach may be safer
than RG6042.
“No one knows
the longer-term implications of knocking down the healthy allele,” says Chandra
Vargeese, Wave’s senior vice president and head of research. “The expanded
allele is the causative factor. So why not leave the healthy allele intact?”
Michelle
Dardengo, on her way to a hiking trail with her dog, says her confidence behind
the wheel has improved since last year.
JOHN LEHMANN
By about 24
hours after injection into the CSF, RG6042 has diffused into neurons in the
brain, where it remains for 3 to 4 months. Bennett says animal studies tracing
the drug’s uptake and activity suggest that monthly injections of the highest
trial dose might begin to measurably improve symptoms after 6 months—if the
drug works.
In January,
Michelle Dardengo began to receive monthly injections of 120 milligrams of
RG6042—the highest dose dispensed in the first study. Along with 45 other
patients from that study, she is taking part in an open-label extension of the
trial. It is designed to produce long-term safety data and to chart all 46
patients’ disease progression. But for Dardengo, it is a trial of the drug’s
promise.
In an in-person
interview in March, shortly after her third such injection, Dardengo appeared
tired. Her speech was sometimes halting and stopped midsentence.
Three months
later, in a telephone interview in June, she spoke fluently, in complete
sentences. She was still gamely answering questions after 2 hours. “I find that
my speaking is a lot better. Like, I can actually finish a sentence,” she
volunteered.
Dardengo also
reports that she and her dogs are walking farther, on rougher trails, than was
her habit in January. She added: “My handwriting is becoming quite legible
now.” In July, Dardengo noted that she has resumed clipping the cat’s claws and
sent a video of herself doing so with apparently steady hands. Marc Dardengo
confirms that his wife’s walking stamina and hand-writing have improved, and he
notes that her violent leg movements while sleeping have virtually disappeared.
And he thinks that the deterioration of her memory has stabilized. “Before the
start of the [open label] trial, I could see her memory [go downhill] over the
course of a year. Since January, [with her] taking this drug, I am not seeing
that type of change.”
But he cautioned
that his wife’s verbal fluency is a moving target. “She has easier days with
conversation more often than before. But she also has days when the dots aren’t
connecting.”
And Joel
Dardengo believes his mother’s memory is getting worse. In June, for example,
she forgot to buy him a birthday cake, a long-standing tradition. Paying for a
pricey meal at a restaurant, she uncharacteristically failed to tip the server.
Trial scientists
Tabrizi and Leavitt strongly caution that one patient’s experience is an
anecdote, not a study. “An n of one is just that,” Leavitt
says, adding: “The placebo effect is very real. We don’t want to put out the
impression that [the drug] is working. Because we don’t know yet.” Tabrizi says
she and her team are doing their all—by phone, email, and in person—to
communicate that to patients.
Today, Michelle
Dardengo says her goal is to ride her bicycle in 6 months. To win Leavitt’s
permission to attempt this, she needs to pass the heel-to-toe walking test
administered to suspected drunk drivers without losing her balance, a feat that
eludes her today.
She is
nonetheless buoyant. “I feel so much hope,” she says. “Things are so different
between my dad and me: I’ve got a life to live.” For her son, her hopes are
even higher: “Joel could definitely be a candidate to potentially never see or
experience Huntington.”
Joel himself is
far more cautious. “I do wish for the best,” he says. “At the same time, I do
prepare for the worst.”
ITALIANO
L'Huntington è
una brutale malattia cerebrale causata da una proteina mutante che ruba
inesorabilmente le vittime del controllo dei loro movimenti e delle loro menti.
I pazienti sono afflitti da movimenti a scatti, senza scopo, chiamati corea.
Possono diventare depressi, irritabili e impulsivi. Soffrono inevitabilmente di
demenza progressiva. Il lento declino inizia tipicamente nella mezza età e dura
dai 15 ai 20 anni, poiché la proteina tossica danneggia e alla fine uccide i
neuroni. Per entrambe le famiglie e gli afflitti, la discesa è dolorosa, non
ultimo perché ogni bambino di una persona affetta ha il 50% di probabilità di
ereditare la malattia fatale.
Negli Stati
Uniti, circa 30.000 persone hanno una malattia sintomatica di Huntington e più
di 200.000 portano la mutazione che assicura che lo svilupperanno. A livello
globale, sono interessate da 3 a 10 persone ogni 100.000, con quelle di
estrazione europea a più alto rischio. In un ampio studio pubblicato nel
Journal of Neurology nel mese di giugno, i ricercatori danesi hanno scoperto
che le persone con la malattia di Huntington avevano quasi nove volte più
probabilità di tentare il suicidio rispetto alla popolazione generale.
Il medico di
Dardengo, Blair Leavitt, ricercatore della malattia di Huntington presso
l'Università della British Columbia (UBC), ha chiesto se voleva unirsi a una
nascente sperimentazione clinica di un nuovo farmaco realizzato da una società
di biotecnologia di Carlsbad, in California, Ionis Pharmaceuticals. Il farmaco,
frutto di 25 anni di ricerca, era una molecola antisenso, un breve tratto di
DNA sintetico fatto su misura per bloccare la produzione della proteina
Huntington.
Partecipare al
processo sarebbe rischioso. Dozzine di farmaci antisenso erano entrati in studi
clinici; pochi erano diventati farmaci approvati. Questa particolare medicina,
iniettata nel fluido che circonda il midollo spinale, non era mai stata messa
nell'uomo. Dardengo potrebbe ricevere il farmaco attivo o potrebbe ottenere un
placebo. Nell'agosto 2015 è diventata "paziente".
Tre anni dopo,
quel processo è famoso. I suoi risultati hanno elettrizzato la comunità della
malattia di Huntington nel dicembre 2017 indicando che il farmaco,
precedentemente IONIS-HTTRx e ora chiamato RG6042, riduce la quantità di
proteina colpevole nel cervello umano - la prima volta che una medicina lo ha
fatto. I dati preliminari pubblicati ad aprile suggeriscono anche miglioramenti
in alcune misure cliniche.
L'azienda
farmaceutica Roche, con sede a Basilea, Svizzera, che ha ottenuto la licenza
RG6042, si sta preparando a trasformarla in uno studio clinico fondamentale,
con dettagli da annunciare nei prossimi mesi. "Avevamo e-mail e telefonate
dei pazienti che dicevano: 'Voglio partecipare a questa [imminente] prova ora.
Sono disposto a trasferirmi casa per farlo ", ricorda Anne Rosser,
neuroscienziata dell'Università di Cardiff, che ha supervisionato uno dei nove
siti nel primo processo.
Lei e altri che
lavorano con i pazienti di Huntington si ritrovano a dover gestire le
aspettative. Ma sebbene il farmaco abbia ottenuto un punteggio elevato per la
sicurezza nel recente studio, non è noto se rallenta o arresti la malattia.
"Non abbiamo prove di efficacia", dice. Dovrà aspettare i risultati
del prossimo processo. E alcuni scienziati si preoccupano ancora della
sicurezza a lungo termine del farmaco.
Data la
disperazione dei pazienti e delle loro famiglie, Louise Vetter, presidente e
CEO della Huntington's Disease Society of America di New York City, afferma che
il suo gruppo e altri "hanno bisogno di riprendere un po 'la speranza. E
questo è davvero difficile. "
La mutazione che
provoca il nome di Huntington dopo che il medico statunitense George
Huntington, che descrisse la malattia nel 1872, si trova vicino alla punta del
braccio corto del cromosoma 4. Le persone sane portano due copie del gene
huntingtina, ciascuna con un massimo di 35 ripetizioni di un trio di
nucleotidi-citosina, adenina e guanina (CAG). Nel gene mutato, questa tripletta
CAG viene ripetuta 36 o più volte, come una balbuzie. Le persone che ereditano
una copia del gene mutante da un genitore producono una proteina huntingtina
mutante con una catena extra lunga di aminoacidi glutammina.
Nessuno è sicuro
di come la proteina mutante danneggia i neuroni. Ma le catene di glutammina più
lunghe di 36 amminoacidi hanno molte più probabilità di aderire l'una
all'altra, formando grumi che possono disturbare le membrane o legare e
inattivare altre molecole all'interno dei neuroni. Le persone afflitte
producono huntingtina mutante per tutta la vita, e il danno si innalza fino
alla comparsa dei sintomi. Più CAG si ripete, prima arriva l'inevitabile
giorno.
Indipendentemente
da come avviene la distruzione, gli scienziati hanno ragionato che, fermando la
produzione della proteina mutante alla sua origine si dovrebbe arrestare il
danno a valle. Nel 1992, Science dichiarò la tecnologia antisenso una delle 10
aree più calde dell'anno; 1 anno dopo è stata pubblicata la mutazione che causa
Huntington. Perché solo un singolo gene era responsabile, chiudendolo con
antisenso sembrava un approccio ovvio per una terapia. L'idea era che i
frammenti sintetici di DNA con una sequenza complementare a parte dell'RNA
messaggero del gene dell'huntingtina (mRNA) si legassero all'mRNA. In questo
caso, il risultante complesso DNA-mRNA evoca un enzima di taglio, RNasi H, che
degrada l'mRNA e ne impedisce la traduzione in proteine.
Ma per 25 anni
l'idea non era pratica. I primi oligonucleotidi antisenso (ASO) non legavano
gli obiettivi degli mRNA in modo efficiente e venivano rapidamente degradati
dagli enzimi. Diverse società si ritirarono. All'inizio degli anni 2000, dopo
aver migliorato chimicamente gli ASO e fatto studi sugli animali, Ionis iniziò
ad adattare gli ASO a specifiche malattie neurologiche, compresa quella per
frenare l'atrofia muscolare spinale.
Nel 2006, i
ricercatori di Ionis, guidati dal vicepresidente della ricerca dell'azienda,
Frank Bennett, hanno avviato una collaborazione con il neuroscienziato Don
Cleveland e il postdoc Holly Kordasiewicz dell'Università della California, a
San Diego, per sviluppare un ASO per attaccare la malattia di Huntington. (Da
allora Kordasiewicz è entrato a far parte di Ionis.) Nel 2012, avevano un ASO
di 20 lettere che invertiva i sintomi e rallentava l'atrofia cerebrale nei
modelli murini di Huntington. Nei macachi, nei cani e nei maiali, i ricercatori
hanno iniettato l'ASO nel liquido cerebrospinale (CSF), che bagna il midollo
spinale e il cervello. Il farmaco ha ridotto la proteina mutante in regioni
chiave del cervello, tra cui la corteccia e il corpo striato, una struttura
cerebrale più profonda che è il primo bersaglio della malattia. E sembrava
essere al sicuro.
All'inizio del
2015, i ricercatori di diverse istituzioni hanno consegnato l'ultimo strumento
necessario per un trial sull'uomo: nuovi test in grado di rilevare i livelli di
proteina huntingtina mutante nel liquido cerebrospinale. Fondamentalmente, un
gruppo ha anche dimostrato che nei topi, la riduzione della proteina mutante
nel liquido cerebrospinale corrispondeva a riduzioni nel cervello stesso. Ora,
i ricercatori potrebbero raccogliere il CSF umano e vedere riflesso come il
loro ASO probabilmente abbia influenzato i livelli della proteina tossica nel
cervello dei pazienti.
Nell'agosto
2015, Dardengo si trovava dalla sua parte all'ospedale UBC, con la faccia
contro il muro. Sentì l'ago di Leavitt iniettare anestetico nella sua piccola
schiena. Dopo di ciò, non sentì nulla mentre ritirava 20 millilitri del suo
fluido spinale e lo rimpiazzò con il farmaco, sciolto in un liquido. Quella fu
la prima di quattro iniezioni mensili. Il processo era in doppio cieco: né lei
né Leavitt sapevano se stava ricevendo il placebo o la più bassa delle dosi
programmate di farmaco attivo, l'unica dose somministrata ai primi soggetti.
Dardengo non si
preoccupava di essere paziente. "Non ho mai avuto paura", ricorda.
“Dr. Leavitt mi ha sempre chiesto: "Sai che potresti morire facendo
questo?" Ho sempre detto: "Sì, ma i miei figli non dovranno
preoccuparsi".
Pensò di
sentirsi meglio dopo l'ultima iniezione mensile, ma non vide alcun
miglioramento nei suoi sintomi. Il suo equilibrio era ancora spento - non osava
indossare i tacchi alti - e si bloccava ancora nel mezzo delle frasi. Mesi
prima, aveva smesso di tagliare gli artigli del suo gatto per paura di ferire
l'animale. Suo marito Marc Dardengo aveva smesso di chiederle di fare
commissioni per i suoi affari perché si perdeva così spesso. Queste cose non
sono cambiate.
Poi, a novembre
2016, lei e Marc hanno ricevuto notizie che li hanno lasciati insensibili. Joel
Dardengo, 27 anni, ha detto ai suoi genitori che era stato testato per la
mutazione di Huntington. Era positivo.
Il processo di
sua madre era un freddo conforto per Joel, un realista profondamente
consapevole delle insidie della scienza. "Puoi vedere su YouTube la
malattia e vedere com'è la partita finale", dice. "Non è il più
bello."
Joel ha detto
alla sua fidanzata che era libera di lasciarlo. Lei ha rifiutato. La coppia,
che desidera avere figli, ha iniziato a discutere della fecondazione in vitro,
che consentirebbe loro di impiantare solo embrioni esenti da Huntington. Ma
Joel, un tecnico dell'elettronica, e la sua fidanzata, una guardia carceraria,
non vedono alcun modo per pagare la procedura da $ 30.000.
Tredici mesi
dopo, alle 12:01 dell'11 dicembre 2017, Michelle ha ricevuto un'e-mail: Ionis
aveva annunciato i risultati del processo in un comunicato stampa. (Un articolo
è ancora in lavorazione.) Dopo aver testato 46 persone, inclusa lei, RG6042
sembrava essere sicuro, con effetti collaterali minimi. E dopo quattro dosi
mensili, i livelli di huntingtina mutata nel CSF dei pazienti erano diminuiti
in modo dose-dipendente: la molecola antisenso sembrava colpire il bersaglio.
I risultati
hanno scatenato un tumulto felice tra le famiglie di Huntington. Michelle e
Marc Dardengo stapparono una bottiglia di chardonnay e brindarono alla
possibilità che i loro figli vivessero una vita libera da Huntington. Vetter, a
5000 chilometri di distanza, ha ricevuto un messaggio dal suo direttore
scientifico che le diceva di controllare immediatamente la sua email. Si
avvicinò al lato della Route 23 del New Jersey, lesse il comunicato stampa di
Ionis e pianse. Alle cliniche della malattia di Huntington da Baltimora, nel
Maryland, a Bochum, in Germania, i telefoni hanno iniziato a ronzare, le e-mail
in arrivo traboccavano e le richieste di appuntamento aumentavano.
All'University College di Londra, sede del leader globale del processo, la
neurologa Sarah Tabrizi, i pazienti si sono brevemente quadruplicati.
Lo stesso giorno
in cui i risultati sono stati rivelati, Roche ha annunciato di aver pagato $ 45
milioni per acquistare il farmaco da Ionis e lo avrebbe trasformato in uno
studio clinico cruciale. Questo studio registrerà centinaia di pazienti in
Europa, Canada e Stati Uniti per un massimo di 2 anni, consentendo alla società
di determinare se RG6042 rallenta o arresta la malattia.
Ionis ha
presentato maggiori dettagli sui primi risultati del trial in due incontri
all'inizio di quest'anno. A marzo, la società ha riferito che i livelli di
proteina mutante nei due gruppi di pazienti con dosi più elevate erano
diminuiti in media del 40% e in alcuni casi fino al 60%. (In animali da
laboratorio, riduzioni più ridotte hanno ridotto i sintomi della malattia). In
aprile, Tabrizi ha riferito che i dati aggregati di tutti i pazienti hanno
mostrato un miglioramento statisticamente significativo in tre delle cinque
misure cliniche della progressione della malattia di Huntington, compresi test
della funzione motoria e cognitiva .
Ma i ricercatori
sono stati rapidi a moderare l'eccitazione risultante con cautela. Bennett
osserva che altre misure cliniche non sono migliorate in modo significativo.
"È sempre possibile trovare alcune correlazioni se si guarda abbastanza
bene. ... L'unico modo per validare veramente questo è fare ulteriori studi a
lungo termine. "
Tabrizi, che
come Leavitt consulta per Roche e le società concorrenti, è d'accordo.
Sottolinea che la prima prova non è stata progettata per valutare l'efficacia.
"La grande domanda che abbiamo ora è: il livello di huntingtina mutata sta
diminuendo nel cervello abbastanza da rallentare la progressione della
malattia?"
Al momento,
nessuno può dire se i livelli proteici ridotti aiuteranno a recuperare i
cervelli già danneggiati, quanto a lungo potrebbero durare gli effetti positivi
o se gli effetti collaterali pericolosi si ripercuoteranno lungo la strada.
Tabrizi dice che i pazienti non dovrebbero aspettarsi "qualche effetto
simile a Lazzaro".
Uno scienziato
non coinvolto nel processo è ancora più cauto. "La gente diceva nel 1993:
'Abbiamo il gene - abbiamo la cura'", ricorda Ole Isacson, un esperto di
malattie neurodegenerative presso l'Harvard Stem Cell Institute. A metà degli
anni '90, ha condotto un primo esperimento fallito cercando di sopprimere la
produzione di huntingtina nei topi usando un ASO. "E 25 anni dopo, ci può
essere una leggera possibilità. Questa non è una corsa sicura.
Sebbene il primo
studio abbia dimostrato che RG6042 è sicuro, alcuni ricercatori hanno ancora
preoccupazioni perché il farmaco sopprime la produzione di entrambe le forme
normali e mutanti della proteina huntingtina. Poiché i geni mutanti
dell'huntingtina variano in sequenza, un farmaco indirizzato a una versione
dell'allele mutante non funzionerebbe per tutti i pazienti. Sarebbe anche
tecnicamente più difficile da sviluppare. Così Ionis ha optato per un ASO non
selettivo che si rivolge a una sequenza trovata in tutti i geni huntingtina,
mutante e normale.
Fare così era un
rischio calcolato. Nessuno sa se l'huntingtina normale sia essenziale per la
salute del cervello negli adulti. (È essenziale per il primo sviluppo: i topi
senza perire come embrioni). Bennett nota che gli effetti dell'RG6042 sono meno
drastici dell'eliminazione completa del gene: "Non stiamo eliminando la
huntingtina [proteina], la stiamo riducendo." Leavitt condivide la sua
fiducia, osservando che nel lavoro interno di Ionis, "Nulla degli studi
preclinici sugli animali ha suggerito alcuna tossicità".
Ma un anno fa,
gli scienziati dell'University of Tennessee Health Science Center (UTHSC) di
Memphis trovarono qualcosa di diverso, come riportato in PLOS Genetics. Hanno
eliminato la proteina huntingtina nei topi a 3, 6 e 9 mesi di età. A tutte le
età, i topi svilupparono gravi deficit motori e comportamentali e una
progressiva patologia cerebrale: le stazioni di ritrasmissione dei segnali dei
thalami-sensoriali e dei segnali motorio degli animali - divennero calcificati
e il loro cervello si atrofizzò.
"Finiremo
per sembrare una Cassandra", dice Paula Dietrich, neurobiologa dell'UTHSC,
che fu il primo autore del giornale. "Portiamo le cattive notizie, e
nessuno vuole sentirlo o crederci."
Dietrich ammette
che i risultati sui topi potrebbero non essere applicabili agli esseri umani.
Ma nota che l'huntingtina è espressa in tutto il cervello e avverte che i
livelli di RG6042 necessari per penetrare nelle strutture più profonde dove
inizia la patologia di Huntington potrebbero avere effetti indesiderati.
"Per raggiungere l'efficacia nello striato, potresti dover esporre altre
regioni del cervello a concentrazioni estremamente elevate", dice.
Un'altra
società, la Wave Life Sciences di Cambridge, nel Massachusetts, sta sviluppando
due farmaci antisenso volti a sopprimere solo il gene mutante, lasciando
intatto quello normale. Gli ASO di Wave hanno come bersaglio due varianti di
sequenza, una o entrambe le quali si verificano nel 70% dei pazienti di
Huntington. Entrambi i farmaci sono in fase iniziale di sperimentazione
clinica, con risultati attesi per la prossima estate e l'azienda ritiene che il
suo approccio potrebbe essere più sicuro di RG6042.
"Nessuno
conosce le implicazioni a lungo termine di abbattere l'allele sano",
afferma Chandra Vargeese, vice presidente senior di Wave e responsabile della
ricerca. "L'allele espanso è il fattore causale. Quindi perché non
lasciare intatto l'allele sano? "
Michelle
Dardengo, sulla strada per un sentiero con il suo cane, dice che la sua fiducia
al volante è migliorata dallo scorso anno.
JOHN LEHMANN
Circa 24 ore
dopo l'iniezione nel liquido cerebrospinale, l'RG6042 si è diffuso nei neuroni
del cervello, dove rimane per 3 o 4 mesi. Bennett afferma che gli studi sugli
animali per tracciare l'assorbimento del farmaco e l'attività suggeriscono che
iniezioni mensili della più alta dose di prova potrebbero iniziare a migliorare
in modo misurabile i sintomi dopo 6 mesi, se il farmaco funziona.
A gennaio,
Michelle Dardengo ha iniziato a ricevere iniezioni mensili di 120 milligrammi
di RG6042, la dose massima erogata nel primo studio. Insieme ad altri 45
pazienti dello studio, sta prendendo parte a un'estensione in aperto della
sperimentazione. È progettato per produrre dati di sicurezza a lungo termine e
per tracciare la progressione della malattia di tutti i 46 pazienti. Ma per
Dardengo, è una prova della promessa della droga.
In un'intervista
di persona a marzo, poco dopo la sua terza iniezione, Dardengo sembrava stanco.
Il suo discorso a volte si fermava e si fermava a metà frase.
Tre mesi dopo,
in un'intervista telefonica a giugno, parlava fluentemente, in frasi complete.
Stava ancora rispondendo alle domande dopo 2 ore. "Trovo che il mio
parlare sia molto meglio. Come, posso davvero finire una frase, "si offrì
volontaria.
Dardengo
riferisce anche che lei ei suoi cani stanno camminando più lontano, su sentieri
più grezzi, di quanto non fosse sua abitudine a gennaio. Ha aggiunto: "La
mia calligrafia sta diventando piuttosto leggibile adesso." A luglio,
Dardengo ha notato che ha ripreso a tagliare gli artigli del gatto e ha inviato
un video di se stessa facendo così con le mani apparentemente ferme. Marc
Dardengo conferma che la resistenza alla deambulazione di sua moglie e la
scrittura a mano sono migliorate, e osserva che i suoi violenti movimenti delle
gambe durante il sonno sono praticamente scomparsi. E pensa che il
deterioramento della sua memoria si sia stabilizzato. "Prima dell'inizio
della prova [open label], ho potuto vedere la sua memoria [andare in discesa]
nel corso di un anno. Da gennaio, [con lei] che prende questo farmaco, non vedo
quel tipo di cambiamento ".
Ma ha avvertito
che la fluidità verbale della moglie è un bersaglio mobile. "Ha giorni più
facili con la conversazione più spesso di prima. Ma ha anche giorni in cui i
punti non si connettono. "
E Joel Dardengo
crede che la memoria di sua madre stia peggiorando. A giugno, ad esempio, ha
dimenticato di comprargli una torta di compleanno, una tradizione di lunga
data. Pagare un pasto costoso in un ristorante, lei insolitamente non è
riuscita a dare la mancia al server.
Gli scienziati
di prova Tabrizi e Leavitt avvertono con forza che l'esperienza di un paziente
è un aneddoto, non uno studio. "An one of one è proprio questo", dice
Leavitt, aggiungendo: "L'effetto placebo è molto reale. Non vogliamo dare
l'impressione che [il farmaco] stia funzionando. Perché non lo sappiamo ancora.
"Tabrizi dice che lei e il suo gruppo stanno facendo tutto per telefono,
e-mail e di persona per comunicarlo ai pazienti.
Oggi, Michelle
Dardengo dice che il suo obiettivo è di andare in bicicletta in 6 mesi. Per
ottenere il permesso di Leavitt di tentare ciò, ha bisogno di passare il test
del tallone ai piedi somministrato a sospetti guidatori ubriachi senza perdere
l'equilibrio, un'impresa che oggi le sfugge.
Nondimeno è
vivace. "Sento tanta speranza", dice. "Le cose sono così diverse
tra me e mio padre: ho una vita da vivere". Per suo figlio, le sue
speranze sono ancora più alte: "Joel potrebbe essere sicuramente un
candidato per non vedere o sperimentare potenzialmente Huntington."
Joel stesso è
molto più cauto. "Desidero il meglio", dice. "Allo stesso tempo,
mi preparo per il peggio."
Da:
http://www.sciencemag.org/news/2018/08/i-feel-so-much-hope-new-drug-keeping-woman-s-deadly-huntington-disease-bay?utm_campaign=news_daily_2018-08-21&et_rid=344224141&et_cid=2301403



Commenti
Posta un commento