Angiogenesis in Cancer / Angiogenesi nel cancro
Angiogenesis in Cancer / Angiogenesi nel cancro
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa

Angiogenesis is a key player in the growth of cancer cells and metastasis of tumors, it can be considered both an attractive target and major challenge in the treatment of cancer.
In this article we take a look at the relationship between angiogenesis and cancer, highlight the role of p38α in the regulation of angiogenesis, explore the existence of non-angiogenic tumors, and discuss the ways to therapeutically target angiogenesis.
In this article we take a look at the relationship between angiogenesis and cancer, highlight the role of p38α in the regulation of angiogenesis, explore the existence of non-angiogenic tumors, and discuss the ways to therapeutically target angiogenesis.
What is angiogenesis?
“Angiogenesis is a process characterized by the formation of new capillaries from pre-existing vasculature, which is essential for normal embryo development and tissue repair. However, angiogenesis has also emerged as a key factor for inflammatory diseases, tumor progression and metastasis,” says Angel Nebreda, Group Leader of the Signalling and Cell Cycle Laboratory, IRB Barcelona.
Forming new blood vessels
Once a tumor grows beyond a few millimeters in size, it can switch on the “angiogenic program” which allows it to directly and indirectly influence the blood supply it is receiving. The tumor’s ability to form new blood vessels guarantees it’s supply of oxygen and nutrients – essential resources for cancer cell growth, invasion into local tissues and progression to distant sites within the body (metastasis).
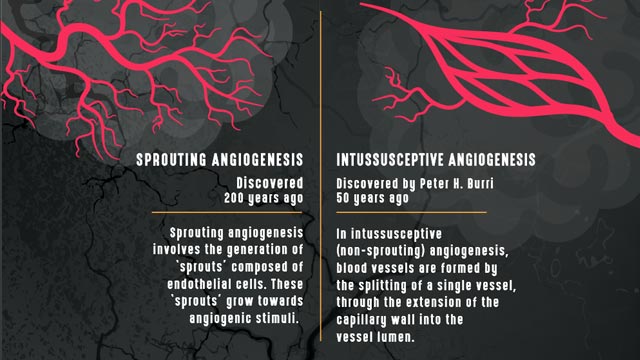
Sprouting vs intussusceptive angiogenesis./ Sprouting vs intussusceptive angiogenesis Credit: Technology Networks.
“The most common type of angiogenesis seen in human tumors is called “sprouting angiogenesis” in which new vessels bud from a pre-existing one, as a new branch forms on a tree, following the occurrence of hypoxia,” explains Francesco Pezzella, professor of tumor pathology, Radcliffe Department of Medicine, John Radcliffe Hospital. Pezzella’s research focuses on tumor angiogenesis, hypoxia and the cell cycle.
Pezzella explains that the most common series of events leading to angiogenesis are those involving the hypoxia-inducible factor (HIF) and vascular endothelial growth factor (VEGF) pathways.
“Following the decrease of oxygen tension in the neoplastic tissue, HIF-1 [Hypoxia-inducible factor-1] becomes “stable” and accumulates inside the nuclei of the cancer cells. Here it induces the transcription of a wide number of hypoxia responsive elements. Among these is VEGF-A, the angiogenic protein most largely involved in this process,” continues Pezzella.
Pezzella explains that in the presence of high levels of VEGF-A, pre-existing vessels can become “leaky” as the endothelial cells loosen their junctions and start to detach from the underlying basal membrane.
“As some endothelial cells detach completely, they start to migrate along the gradient of VEGF-A molecules towards the source of the angiogenic signal. At the same time the endothelial cells secrete angiopoietin-2 that, competing with angiopoietin-1, removes the inhibitory effect of the latter,” says Pezzella.
This process causes the endothelial cells to start proliferating, forming a cord of newly formed cells along the gradient of proangiogenic factors. Pezzella elaborates: “As this new formation becomes longer, a lumen develops, oxygenated blood enters, and as hypoxia is eliminated, secretion of angiogenic factors is stopped and the new vessels resume a quiescent state.”
“The endothelial cells stop dividing with only the most advanced cells keeping proliferating. Eventually the tip of the new vessels will meet another vessel, fuse and canalize and the all new vessel will be quiescent again,” he adds.
Pezzella explains that the most common series of events leading to angiogenesis are those involving the hypoxia-inducible factor (HIF) and vascular endothelial growth factor (VEGF) pathways.
“Following the decrease of oxygen tension in the neoplastic tissue, HIF-1 [Hypoxia-inducible factor-1] becomes “stable” and accumulates inside the nuclei of the cancer cells. Here it induces the transcription of a wide number of hypoxia responsive elements. Among these is VEGF-A, the angiogenic protein most largely involved in this process,” continues Pezzella.
Pezzella explains that in the presence of high levels of VEGF-A, pre-existing vessels can become “leaky” as the endothelial cells loosen their junctions and start to detach from the underlying basal membrane.
“As some endothelial cells detach completely, they start to migrate along the gradient of VEGF-A molecules towards the source of the angiogenic signal. At the same time the endothelial cells secrete angiopoietin-2 that, competing with angiopoietin-1, removes the inhibitory effect of the latter,” says Pezzella.
This process causes the endothelial cells to start proliferating, forming a cord of newly formed cells along the gradient of proangiogenic factors. Pezzella elaborates: “As this new formation becomes longer, a lumen develops, oxygenated blood enters, and as hypoxia is eliminated, secretion of angiogenic factors is stopped and the new vessels resume a quiescent state.”
“The endothelial cells stop dividing with only the most advanced cells keeping proliferating. Eventually the tip of the new vessels will meet another vessel, fuse and canalize and the all new vessel will be quiescent again,” he adds.
p38α and its involvement in tumor angiogenesis
Nebreda’s group investigate how cells receive, interpret and consequently respond to information. “Our main interests include; the mechanisms of tumor cell homeostasis and chemoresistance, cross talk between cancer cells and stromal cells, and targeted therapies,” explains Nebreda.
The team’s attention is directed more specifically towards the p38 mitogen-activated protein kinase (MAPK) signaling pathway. Using a combination of molecular and cellular studies alongside the use of mouse models they have been able to analyze the pathway’s in vivo function and investigate its involvement in tumor angiogenesis.
“p38α is a ubiquitous protein kinase activated by stress, inflammatory cytokines, and other stimuli,” explains Nebreda.
Whilst various studies have implicated p38α signaling in the regulation of tumor initiation and progression, its exact role within the tumor microenvironment, and how this contributes to tumor growth has remained elusive.
Whilst initially considered a tumor suppressor, mounting evidence now suggests that p38α may possess a dual function – as both a tumor suppressor and promotor – in different types of cancer.
“Work from our lab and others has provided good evidence indicating that p38α signaling contributes to tumor development by acting both in cancer cells and in normal cells of the tumor stroma,” says Nebreda.
Under “normal” conditions regular growth of tissues is sustained through the body’s ability to maintain a “homeostatic balance” between factors that promote angiogenesis (proangiogenic) and those that inhibit angiogenesis (antiangiogenic).
Nebreda touches on p38α’s ability to “tip the balance” between pro- and anti-angiogenic factors: “Studies with cultured cancer cell lines have shown that p38α controls the expression of vascular endothelial growth factor (VEGF) – a key proangiogenic factor. However, there is also evidence that p38α sometimes negatively regulates endothelial cell survival, proliferation, and differentiation, suggesting antiangiogenic properties.”
The group recently published a paper in Nature Communications describing p38α’s involvement in the regulation of angiogenesis in both human and mouse colon cancer. The team discovered a function of p38α in mesenchymal stem cells – which can localize around blood vessels. P38α represses angiogenesis by specifically exerting its action in mesenchymal cells. By inhibiting p38α’s activity using chemical compounds and genetic mouse models, they were able to stimulate the formation of new blood vessels in tumors.
“Our results indicate that p38α signaling in mesenchymal cells can negatively regulate the angiogenic program in tumors,” says Raquel Batlle, first author of the paper.
The discovery of non-angiogenic tumors
In the mid-1990s Pezzella’s laboratory discovered that some advanced and aggressive cancers of the lung were able to grow without the formation of any new vessels. The team observed tumors of the lung that “lived among” the normal lung tissue, with the cancer cells occupying alveoli – the small cavities within the lung. They noted that the only blood vessels present were those belonging to the “normal” lung tissue.
“After the publication of the first two papers describing these tumors, in 1996 and 1997, we started to look at their main characteristics,” explains Pezzella.
The first data to emerge indicated that these non-angiogenic tumors were in fact still hypoxic and some angiogenic factors were overexpressed, despite this, angiogenesis was not induced.
Pezzella also notes that: “Most of the tumors displayed angiogenic and non-angiogenic portions, and during the history of the disease, a primary angiogenic cancer can relapse with a non-angiogenic metastases and vice versa.”
The team is now focusing efforts towards understanding why and how cells decide to behave in a non-angiogenic rather than angiogenic way (and vice versa). Pezzella explains that other groups have started looking at the mechanisms by which a cancer cell can exploit a preexisting vessel: “this process has since been named “vascular co-option” and is an active mechanism that can be interfered with, causing cell death and /or inhibition of cancer progression.” Vascular co-option can influence cancer progression, metastasis and a patient’s response to treatment. Whilst the exact mechanisms responsible for driving this process are yet to be uncovered, both tumor cell invasion and tumor cell adhesion pathways are known to play a role.
Since Pezzella’s discovery almost 20 years ago, numerous other non-angiogenic tumors have been described in other organs including the liver, brain and lymph nodes.
“As each of these organs is obviously very different from the lung and from each other, also the nature of the non-angiogenic cancer cells and the mechanism of co-option appears to differ from the lung tumors,” notes Pezzella.
The team is now focusing efforts towards understanding why and how cells decide to behave in a non-angiogenic rather than angiogenic way (and vice versa). Pezzella explains that other groups have started looking at the mechanisms by which a cancer cell can exploit a preexisting vessel: “this process has since been named “vascular co-option” and is an active mechanism that can be interfered with, causing cell death and /or inhibition of cancer progression.” Vascular co-option can influence cancer progression, metastasis and a patient’s response to treatment. Whilst the exact mechanisms responsible for driving this process are yet to be uncovered, both tumor cell invasion and tumor cell adhesion pathways are known to play a role.
Since Pezzella’s discovery almost 20 years ago, numerous other non-angiogenic tumors have been described in other organs including the liver, brain and lymph nodes.
“As each of these organs is obviously very different from the lung and from each other, also the nature of the non-angiogenic cancer cells and the mechanism of co-option appears to differ from the lung tumors,” notes Pezzella.
Therapeutically targeting angiogenesis
Regulation of angiogenesis is one approach to treating cancer. There are numerous antiangiogenic tactics, which can involve:
- Increasing the activity of antiangiogenic factor to attempt to “rebalance” or suppress angiogenesis
- Inhibiting the ability of the cancer cells to obtain vital nutrients required for growth
- Destroying existing blood vessels responsible to “feeding” the tumor.
- Preventing new blood vessel formation by targeting hypoxia-inducible factors
Several antiangiogenesis drugs have been developed and some are already FDA-approved for the treatment of cancer. Most agents target VEGF, its receptor or the activated signaling pathways – for example bevacizumab, aflibercept, and ramucirumab. However, there are inconsistent effects in different tumor types and some patients can develop resistance to these therapies.
Pezzella elaborates on some of the challenges associated with these types of drugs: “Both in animal models and in human trials, advancement of tumors during antiangiogenic treatment has been observed. One of the main reasons for such a disappointing outcome links back to the assumption that a “universal mechanism” fuels angiogenesis – antiangiogenic treatments were given to everybody in a sort of “carpet bombing approach” without looking for patients possessing tumors that are perhaps more sensitive than others.”
In contrast to the above antiangiogenic strategies, there is evidence to suggest that vascular promotion, rather than inhibition, could be a viable strategy for improving cancer therapy – by facilitating chemotherapy drug delivery.
Batlle explains this concept, drawing upon their understanding of p38α’s involvement in angiogenesis: “We have described a new mechanism that regulates blood vessel formation, suggesting that p38α inhibitors may help to enhance the tumor vasculature in a controlled manner, and facilitate chemotherapy-based cancer treatments.”
“Therefore, our data provide additional evidence supporting the idea that vascular promotion could be a useful strategy to improve cancer therapy.” Batlle also notes that vascular promotion can be associated with less hypoxia and less desmoplasia, and the decrease in these two processes has been reported to reduce metastasis in pancreatic ductal adenocarcinomas.
A clearer understanding of the mechanisms behind tumor angiogenesis is enabling researchers to develop antiangiogenic agents capable of simultaneously targeting numerous pathways. In addition, greater understanding of the factors regulating angiogenesis (e.g. p38α) are driving new strategies against cancer that take advantage of enhanced angiogenesis.
“As a more complete picture of the interaction between cancer cells and blood vessels emerges, we can devise new “evidence-based” treatments that can target both new vessel formation and the hijacking of existing vessels, as well as finding new targets tailored to either non-angiogenic or angiogenic cancer cells,” concludes Pezzella.
ITALIANO
L'angiogenesi è un attore chiave nella crescita delle cellule tumorali e nelle metastasi dei tumori, può essere considerata sia un bersaglio attraente sia una grande sfida nel trattamento del cancro.
In questo articolo esaminiamo la relazione tra angiogenesi e cancro, evidenziamo il ruolo della p38α nella regolazione dell'angiogenesi, esploriamo l'esistenza di tumori non angiogenici e discutiamo i modi per colpire terapeuticamente l'angiogenesi.
Che cos'è l'angiogenesi?
“L'angiogenesi è un processo caratterizzato dalla formazione di nuovi capillari da vascolarizzazione preesistente, che è essenziale per il normale sviluppo dell'embrione e la riparazione dei tessuti. Tuttavia, l'angiogenesi è emersa anche come fattore chiave per le malattie infiammatorie, la progressione del tumore e le metastasi ", afferma Angel Nebreda, Group Leader del Signaling and Cell Cycle Laboratory, IRB di Barcellona.
Formare nuovi vasi sanguigni
Una volta che un tumore cresce oltre alcuni millimetri, può attivare il "programma angiogenico" che gli consente di influenzare direttamente e indirettamente l'afflusso di sangue che sta ricevendo. La capacità del tumore di formare nuovi vasi sanguigni garantisce la fornitura di ossigeno e sostanze nutritive - risorse essenziali per la crescita delle cellule tumorali, l'invasione nei tessuti locali e la progressione verso siti distanti all'interno del corpo (metastasi).
"Il tipo più comune di angiogenesi visto nei tumori umani è chiamato" angiogenesi che germoglia "in cui i nuovi vasi nascono da uno preesistente, mentre un nuovo ramo si forma su un albero, a seguito del verificarsi di ipossia", spiega Francesco Pezzella, professore di patologia tumorale, Dipartimento di Medicina di Radcliffe, John Radcliffe Hospital. La ricerca di Pezzella si concentra su angiogenesi tumorale, ipossia e ciclo cellulare.
Pezzella spiega che le serie più comuni di eventi che portano all'angiogenesi sono quelle che coinvolgono le vie del fattore di induzione ipossia (HIF) e del fattore di crescita endoteliale vascolare (VEGF).
"A seguito della diminuzione della tensione di ossigeno nel tessuto neoplastico, HIF-1 [fattore 1 inducibile dall'ipossia] diventa" stabile "e si accumula all'interno dei nuclei delle cellule tumorali. Qui induce la trascrizione di un ampio numero di elementi sensibili all'ipossia. Tra questi vi è il VEGF-A, la proteina angiogenica maggiormente coinvolta in questo processo ”, continua Pezzella.
Pezzella spiega che in presenza di alti livelli di VEGF-A, i vasi preesistenti possono diventare “colanti” quando le cellule endoteliali allentano le loro giunzioni e iniziano a staccarsi dalla membrana basale sottostante.
“Quando alcune cellule endoteliali si staccano completamente, iniziano a migrare lungo il gradiente delle molecole VEGF-A verso la fonte del segnale angiogenico. Allo stesso tempo, le cellule endoteliali secernono l'angiopoietina-2 che, in competizione con l'angiopoietina-1, rimuove l'effetto inibitorio di quest'ultima ", afferma Pezzella.
Questo processo provoca la proliferazione delle cellule endoteliali, formando un cordone di cellule di nuova formazione lungo il gradiente dei fattori proangiogenici. Pezzella elabora: "Man mano che questa nuova formazione si allunga, si sviluppa un lume, entra sangue ossigenato e quando viene eliminata l'ipossia, la secrezione di fattori angiogenici viene interrotta e i nuovi vasi sanguigni riprendono uno stato di quiescenza."
“Le cellule endoteliali smettono di dividersi con solo le cellule più avanzate che continuano a proliferare. Alla fine la punta dei nuovi vasi sanguigni incontrerà un'altro vaso sanguigno, si fonderà e canalizzerà e tutte le nuovi vasi sanguigni saranno nuovamente quiescenti ”, aggiunge.
p38α e il suo coinvolgimento nell'angiogenesi tumorale
Il gruppo di Nebreda indaga su come le cellule ricevono, interpretano e di conseguenza rispondono alle informazioni. “I nostri interessi principali includono; i meccanismi dell'omeostasi e della chemoresistenza delle cellule tumorali, i dialoghi incrociati tra cellule tumorali e cellule stromali e terapie mirate ", spiega Nebreda.
L'attenzione del gruppo è rivolta in modo più specifico alla via di segnalazione della proteina chinasi attivata dal mitogeno p38 (MAPK). Usando una combinazione di studi molecolari e cellulari insieme all'uso di modelli murini, sono stati in grado di analizzare la funzione in vivo del percorso e indagare il suo coinvolgimento nell'angiogenesi tumorale.
"La p38α è una proteina chinasi onnipresente attivata da stress, citochine infiammatorie e altri stimoli", spiega Nebreda.
Mentre vari studi hanno implicato la segnalazione di p38α nella regolazione dell'inizio e della progressione del tumore, il suo ruolo esatto all'interno del microambiente tumorale e come ciò contribuisce alla crescita tumorale è rimasto sfuggente.
Mentre inizialmente considerato un soppressore del tumore, prove crescenti ora suggeriscono che la p38α può avere una duplice funzione - sia come soppressore del tumore sia come promotore - in diversi tipi di tumore.
"Il lavoro del nostro laboratorio e di altri ha fornito buone prove che indicano che la segnalazione di p38α contribuisce allo sviluppo del tumore agendo sia nelle cellule tumorali che nelle cellule normali dello stroma tumorale", afferma Nebreda.
In condizioni "normali" la crescita regolare dei tessuti è sostenuta dalla capacità del corpo di mantenere un "equilibrio omeostatico" tra i fattori che promuovono l'angiogenesi (proangiogenica) e quelli che inibiscono l'angiogenesi (antiangiogenica).
Nebreda tocca la capacità di p38α di "ribaltare l'equilibrio" tra fattori pro e anti-angiogenici: "Studi con linee cellulari tumorali coltivate hanno dimostrato che p38α controlla l'espressione del fattore di crescita endoteliale vascolare (VEGF) - un fattore proangiogenico chiave. Tuttavia, ci sono anche prove che a volte p38α regola negativamente la sopravvivenza, la proliferazione e la differenziazione delle cellule endoteliali, suggerendo proprietà antiangiogeniche ".
Il gruppo ha recentemente pubblicato un articolo su Nature Communications che descrive il coinvolgimento di p38α nella regolazione dell'angiogenesi nel tumore del colon umano e del topo. Il gruppo ha scoperto una funzione della p38α nelle cellule staminali mesenchimali, che può localizzarsi attorno ai vasi sanguigni. P38α reprime l'angiogenesi esercitando in modo specifico la sua azione nelle cellule mesenchimali. Inibendo l'attività di p38α utilizzando composti chimici e modelli genetici di topo, sono stati in grado di stimolare la formazione di nuovi vasi sanguigni nei tumori.
"I nostri risultati indicano che la segnalazione di p38α nelle cellule mesenchimali può regolare negativamente il programma angiogenico nei tumori", afferma Raquel Batlle, primo autore dell'articolo.
La scoperta di tumori non angiogenici
A metà degli anni '90 il laboratorio di Pezzella scoprì che alcuni tumori polmonari avanzati e aggressivi erano in grado di crescere senza la formazione di nuovi vasi sanguigni. Il gruppo ha osservato tumori del polmone che "vivevano tra" il normale tessuto polmonare, con le cellule tumorali che occupavano gli alveoli - le piccole cavità all'interno del polmone. Hanno notato che gli unici vasi sanguigni presenti erano quelli appartenenti al tessuto polmonare "normale".
"Dopo la pubblicazione dei primi due articoli che descrivono questi tumori, nel 1996 e nel 1997, abbiamo iniziato a esaminare le loro caratteristiche principali", spiega Pezzella.
I primi dati emersi indicavano che questi tumori non angiogenici erano in realtà ancora ipossici e che alcuni fattori angiogenici erano sovraespressi, nonostante ciò, l'angiogenesi non era indotta.
Pezzella osserva inoltre che: "La maggior parte dei tumori presentava porzioni angiogeniche e non angiogeniche e, durante la storia della malattia, un tumore angiogenico primario può ricadere con metastasi non angiogeniche e viceversa".
Il gruppo sta ora concentrando gli sforzi per capire perché e come le cellule decidono di comportarsi in modo non angiogenico piuttosto che angiogenico (e viceversa). Pezzella spiega che altri gruppi hanno iniziato a esaminare i meccanismi attraverso i quali una cellula cancerosa può sfruttare un vaso sanguigno preesistente: "da allora questo processo è stato chiamato" cooptazione vascolare "ed è un meccanismo attivo che può essere interferito, causando la morte cellulare e / o inibizione della progressione del cancro. ”La cooptazione vascolare può influenzare la progressione del cancro, le metastasi e la risposta del paziente al trattamento. Mentre i meccanismi esatti responsabili di guidare questo processo devono ancora essere scoperti, sia l'invasione delle cellule tumorali sia i percorsi di adesione delle cellule tumorali sono noti per avere un ruolo.
Dalla scoperta di Pezzella quasi 20 anni fa, numerosi altri tumori non angiogenici sono stati descritti in altri organi tra cui fegato, cervello e linfonodi.
"Poiché ciascuno di questi organi è ovviamente molto diverso dal polmone e l'uno dall'altro, anche la natura delle cellule tumorali non angiogeniche e il meccanismo di cooptazione sembrano differire dai tumori polmonari", osserva Pezzella.
Obiettivo terapeutico dell'angiogenesi
La regolazione dell'angiogenesi è un approccio per il trattamento del cancro. Esistono numerose tattiche antiangiogeniche, che possono comportare:
Aumentare l'attività del fattore antiangiogenico per tentare di "riequilibrare" o sopprimere l'angiogenesi
Inibendo la capacità delle cellule tumorali di ottenere nutrienti vitali necessari per la crescita
Distruggere i vasi sanguigni esistenti responsabili di "nutrire" il tumore.
Prevenire la formazione di nuovi vasi sanguigni prendendo di mira fattori inducibili dall'ipossia
Sono stati sviluppati diversi farmaci antiangiogenesi e alcuni sono già approvati dalla FDA per il trattamento del cancro. La maggior parte degli agenti prende di mira VEGF, il suo recettore o le vie di segnalazione attivate, ad esempio bevacizumab, aflibercept e ramucirumab. Tuttavia, ci sono effetti incoerenti nei diversi tipi di tumore e alcuni pazienti possono sviluppare resistenza a queste terapie.
Pezzella elabora alcune delle sfide associate a questi tipi di farmaci: “Sia nei modelli animali che nelle sperimentazioni sull'uomo, è stato osservato l'avanzamento dei tumori durante il trattamento antiangiogenico. Uno dei motivi principali di un risultato così deludente è ricondotto al presupposto che un "meccanismo universale" alimenta l'angiogenesi - i trattamenti antiangiogenici sono stati dati a tutti in una sorta di "approccio di bombardamento a tappeto" senza cercare pazienti con tumori forse più sensibili di altri."
Contrariamente alle strategie antiangiogeniche di cui sopra, ci sono prove che suggeriscono che la promozione vascolare, piuttosto che l'inibizione, potrebbe essere una strategia praticabile per migliorare la terapia del cancro, facilitando la somministrazione di farmaci chemioterapici.
Batlle spiega questo concetto, attingendo alla loro comprensione del coinvolgimento di p38α nell'angiogenesi: “Abbiamo descritto un nuovo meccanismo che regola la formazione dei vasi sanguigni, suggerendo che gli inibitori di p38α possono aiutare a migliorare il sistema vascolare in modo controllato e facilitare il cancro basato sulla chemioterapia trattamenti “.
"Pertanto, i nostri dati forniscono ulteriori prove a sostegno dell'idea che la promozione vascolare potrebbe essere una strategia utile per migliorare la terapia del cancro". Batlle nota inoltre che la promozione vascolare può essere associata a meno ipossia e meno desmoplasia, e la riduzione di questi due processi è stata riportato per ridurre le metastasi negli adenocarcinomi del dotto pancreatico.
Una comprensione più chiara dei meccanismi alla base dell'angiogenesi tumorale sta permettendo ai ricercatori di sviluppare agenti antiangiogenici in grado di indirizzare contemporaneamente numerosi percorsi. Inoltre, una maggiore comprensione dei fattori che regolano l'angiogenesi (ad esempio p38α) sta guidando nuove strategie contro il cancro che sfruttano l'angiogenesi migliorata.
"Man mano che emerge un quadro più completo dell'interazione tra cellule tumorali e vasi sanguigni, possiamo escogitare nuovi trattamenti" basati sull'evidenza "in grado di colpire sia la formazione di nuovi vasi sia il dirottamento di vasi esistenti, oltre a trovare nuovi obiettivi su misura per entrambi cellule tumorali non angiogeniche o angiogeniche ", conclude Pezzella.
Da:
https://www.technologynetworks.com/cancer-research/articles/angiogenesis-in-cancer-322818?utm_campaign=NEWSLETTER_TN_Cancer%20Research&utm_source=hs_email&utm_medium=email&utm_content=76649948&_hsenc=p2ANqtz-_Qpjaq3NbaTqvd39nEwMzWYsywkxreGii__thwYHdY-LAwzPxn1JBmg38AWUeI3WTpuuABc8bOU1AZsTPOTnj3iiPGGi7Giabf7FbT24Jvd9W0gAQ&_hsmi=76649949



Commenti
Posta un commento