Problems about genetically engineered T cells for cancer immunotherapy / Problemi relativi alle cellule T geneticamente modificate per l'immunoterapia del cancro
Problems about genetically engineered T cells for cancer immunotherapy / Problemi relativi alle cellule T geneticamente modificate per l'immunoterapia del cancro
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
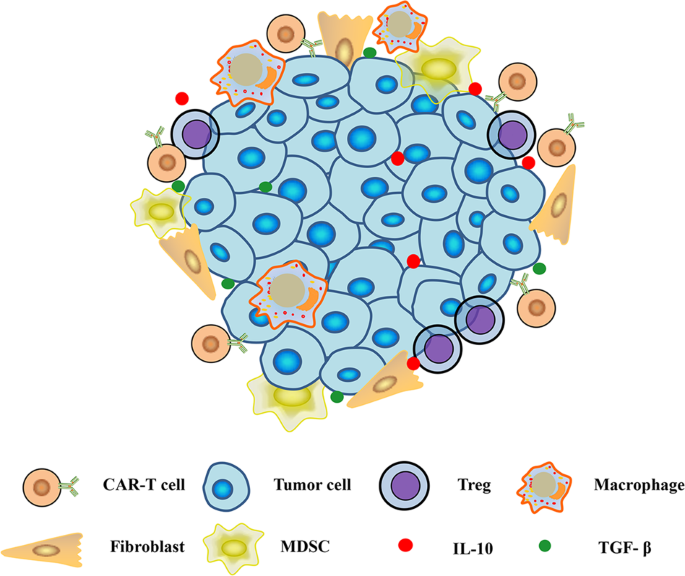
Immunosuppressive microenvironment in solid tumors. MDSC myeloid-derived suppressor cell, Treg regulatory T cell, TAM tumor-associated macrophage, TAF tumor-associated fibroblast / Microambiente immunosoppressivo nei tumori solidi.Cellula soppressore derivata da mieloide MDSC, cellula T regolatrice di Treg, macrofago associato a tumore TAM, fibroblasto associato a tumore TAF
Other challenges for engineered T therapy
Genetically engineered T cells have benefited patients in the treatment of tumors, but other obstacles have challenged the application of genetically modified T cells, even in the treatment of hematological malignancies.
Failure of CAR-T cell generation
Although the total number of CAR-T cells used for infusion is small (108–109), the failure to produce sufficient engineered T cells has been observed, which challenges the pharmaceutics of this therapy. Many factors can result in the failure of CAR-T production. Cancer patients generally undergo chemotherapy and other regimens, leading to lymphopenia, which affects the quality and quantity of harvested T cells. Leukapheresis improves the quality and purity of T cells, but poor expansion of CAR-T cells after engineering impedes the generation of sufficient numbers of modified T cells. T cells with different phenotypes exert distinct functions. Previous studies demonstrated that CAR-T cells with a central memory T cell phenotype (CD8+CD45RA−CD45RO+CCR7+) are closely related to antitumor activity. In addition to the central memory phenotype, the CD4+/CD8+ ratio and the differential expression of other molecules in the infused T cells might affect the antitumor capability of CAR-T therapy. Therefore, obtaining enough CAR-T cells for cancer immunotherapy means not only generating a sufficient number of T cells but also producing a defined phenotype and a specified ratio of subsets within the modified T cells.
There are many cell culture strategies used for the production of CAR-T cells. Magnetic beads coated with CD3/CD28 antibodies are often combined with cytokines, such as IL-2, IL-7, and IL-15, for the activation and expansion of CAR-T cells Artificial APCs are also used to greatly expand and generate antigen-specific CAR-T cells345. CD4- and CD8-positive cells can be enriched for producing CAR-T cells, and a defined ratio of CD4 and CD8 cells can ultimately be ensured. In addition to differences in the expansion protocol, CAR-T cells with different intracellular costimulatory domains in their CAR constructs exhibited different expansion and phenotype properties. The lengths of the CAR extracellular spacers used are critical to CAR-T cell therapy. It is likely that formulating CAR-T cells with a defined composition of different subsets can enhance the uniformity of CAR-T products, which could be used in further investigations to draw more definitive conclusions.
Relapse after CAR-T therapy
Although CD19-targeted CAR-T cells achieved dramatic antitumor efficacy in treating hematological malignancies a considerable number of patients with CR have relapsed after CAR-T therapy. Although the mechanism of relapse has not been fully elucidated, antigen loss and poor CAR-T persistence are thought to contribute to the relapse of disease.
Tumors in a small proportion of pediatric and adult responders relapsed after treatment with CD19 CAR-T cells because of CD19 deletion and CD19 tumor cell growth, which results from acquired resistance to CAR-T therapy due to antigen escape. To prevent the recurrence of the tumor, broader immune activation is required to elicit a second wave of immunity in addition to CAR-T cell therapy355. Recently, other novel mechanisms accounting for the relapse of hematological malignancies after CD19 CAR-T cell therapy have been reported. CD19 molecules on tumor cells transduced with CAR vectors can be masked by CAR molecules, leading to their escape from attack by CAR-T cells and the recurrence of malignancy. A target antigen recognized by CAR-T cells on the tumor cells can even be removed by CAR-T cells through trogocytosis, resulting in a reduction in the antigen and fratricide between CAR-T cells Another obstacle is the poor persistence of CAR-T cells. The efficacy of CAR-T cell therapy is closely related to the in vivo expansion and survival of cells356. Many strategies discussed above, including the optimization of the CAR construct and preconditioning and infusion strategies, can prolong the survival of CAR-T cells and enhance their antitumor efficacy.
Side effects
CAR-T cells target the antigen expressed on the surface of tumor cells. This antigen is generally expressed on normal cells and not exclusively on tumor cells. CAR-T cells attack normal tissues when clearing tumor cells, resulting in side effects in normal tissues, which are called “on-target, off-tumor” side effects. Clinical studies in which CAR-T cells infused for cancer therapy have recognized HER, CAIX, CD19, and mesothelin have shown damage to normal tissues. Many strategies have been developed for enhancing the safety of CAR-T cell therapy, such as the targeting of other antigens, such as CD1a, in place of CD19, equipping CAR-T cells with safety switches by introducing suicide genes, expressing a split CAR molecule, constructing inhibitory CAR constructs or dual antigen-activated CAR-T cells to recognize tumor cells more specifically, and tuning the affinity of the scFv used for the CAR construction to minimize the incidence of severe adverse effects. In addition, the local injection of CAR-T cells can also reduce off-target effects, since the CAR-T cells are regionally restricted. Further research may seek to improve the safety of CAR-T cells, especially regarding the selection of the CAR-recognized antigen, the development of controllable CAR-T cells, and the optimization of infusion strategies.
Among the side effects of CAR-T cells, CRS is the most common adverse effect. CRS resulting from CD19 CAR-T cell therapy is tolerable if properly treated. CRS is induced by the robust activation of the immune system during CAR-T cell therapy, triggering the release of a large number of cytokines, including IL-6, IL-10, IFN-y, TNF-α, GM-CSF, and other cytokines, and causing severe adverse effects. The severity of the CRS-related side effects is closely related to the amounts of released cytokines373, tumor burden, and the structure of the CAR272. mAbs against IL-6Ra (tocilizumab or sarilumab) are used for the treatment of CRS in addition to the use of corticosteroids to inhibit inflammatory reactions152. The blockade of IL-1β or TNF-α is another strategy used to treat CRS in addition to IL-6, but the benefits for patients are yet to be documented. GM-CSF-knockout CAR-T cells resulted in minimal incidence of CRS compared with GM-CSF-intact CAR-T cells372, indicating the pivotal role of CAR-T-derived GM-CSF in the occurrence of CRS.
In addition to CRS, varying degrees of neurotoxicity have occurred as a result of the clinical application of CAR-T cell therapy for treating hematological tumors. Indeed, neurotoxicity is always closely related to CRS. Mild neurotoxicity is transient and reversible. The appearance of acute and severe neurotoxicity is usually accompanied by severe CRS symptoms due to the increased permeability of the blood–brain barrier. Although the mechanism of the incidence of neurotoxicity is largely unknown, many clues have indicated that inflammatory cytokines affect the function of the blood–brain barrier and endothelial cells, contributing to neurotoxicity. In nonhuman primates, CAR-T cell-mediated neurotoxicity was also confirmed to be associated with pro-inflammatory CSF cytokines and pan-T-cell encephalitis382. For the treatment of neurotoxicity caused by CAR-T cell therapy, a regimen should be prescribed that is dependent on the severity. Anti-IL-6 therapy can reverse side effects at the early stage. For the treatment of late-stage neurotoxicity, corticosteroids are recommended. Patients with nonconvulsive and convulsive status epilepticus should be managed with benzodiazepines and additional antiepileptics.
TCR-T cells target HLA-presented antigens on tumor cells. The potential side effects of TCR-T cell therapy are decreased compared to those of CAR-T cell therapy. However, safety concerns should be paid more attention when the affinity or other characteristics of the TCR are modified. TCR-T cells with enhanced affinity always improve the recognition of the HLA-presented antigens, but side effects usually accompany this. In a pilot study using affinity-enhanced TCR-T therapy for the treatment of melanoma and other cancers, two of the nine patients died of leukoencephalopathy after treatment with MAGE-3 high-affinity TCR-T cells because of off-target toxicity. In another clinical trial for the treatment of melanoma and myeloma, two patients died of cardiotoxicity after MAGE-3-specific, affinity-enhanced TCR-T cell therapy, mainly due to cross-reaction with the titin peptide, which is expressed in heart tissue. Therefore, meticulous investigation of affinity-enhanced TCR-T therapy is needed before it can provide clinical benefit to cancer patients.
Outlook
Among cancer immunotherapies, CAR-T cell therapy has shown robust antitumor efficacy for the treatment of hematological malignancies. Upon the approval of CAR-T cell therapy for the treatment of leukemia and lymphoma, more patients will be able to benefit from this new therapy, but side effects, relapses after CR, and long-term monitoring should be of concern. CAR-T cell therapy for solid tumors is far from satisfactory. Endeavors should be made to overcome immunosuppression mediated by the microenvironment of solid tumors. TCR-T cells and other genetically engineered immune cells have produced effective immunity during cancer treatment in preclinical and clinical trials, and efforts should be made to enroll more patients to obtain the benefits of TCR-T therapy. It is hoped that another breakthrough in gene-engineered-T cell therapy for tumors is coming soon.
ITALIANO
Altre sfide per la terapia a T ingegnerizzata
Le cellule T geneticamente modificate hanno giovato ai pazienti nel trattamento dei tumori, ma altri ostacoli hanno sfidato l'applicazione di cellule T geneticamente modificate, anche nel trattamento delle neoplasie ematologiche.
Fallimento della generazione delle cellule CAR-T
Sebbene il numero totale di cellule CAR-T utilizzate per l'infusione sia piccolo (108-109), è stata osservata la mancata produzione di cellule T ingegnerizzate sufficienti, il che sfida i prodotti farmaceutici di questa terapia. Molti fattori possono causare il fallimento della produzione CAR-T. I pazienti affetti da cancro generalmente subiscono la chemioterapia e altri regimi, che portano alla linfopenia, che influenza la qualità e la quantità delle cellule T raccolte. Leucapheresis migliora la qualità e la purezza delle cellule T, ma la scarsa espansione delle cellule CAR-T dopo l'ingegneria impedisce la generazione di un numero sufficiente di cellule T modificate. Le cellule T con fenotipi diversi esercitano funzioni distinte. Precedenti studi hanno dimostrato che le cellule CAR-T con un fenotipo di cellule T a memoria centrale (CD8 + CD45RA − CD45RO + CCR7 +) sono strettamente correlate all'attività antitumorale. Oltre al fenotipo di memoria centrale, il rapporto CD4 + / CD8 + e l'espressione differenziale di altre molecole nelle cellule T infuse potrebbero influenzare la capacità antitumorale della terapia CAR-T. Pertanto, ottenere abbastanza cellule CAR-T per l'immunoterapia del cancro significa non solo generare un numero sufficiente di cellule T, ma anche produrre un fenotipo definito e un rapporto specificato di sottoinsiemi all'interno delle cellule T modificate.
Esistono molte strategie di coltura cellulare utilizzate per la produzione di cellule CAR-T. Le perle magnetiche rivestite con anticorpi CD3 / CD28 sono spesso combinate con citochine, come IL-2, IL-7 e IL-15, per l'attivazione e l'espansione delle cellule CAR-T Gli APC artificiali vengono anche utilizzati per espandere notevolmente e generare antigene -celle CAR-T specifiche345. Le cellule CD4 e CD8 positive possono essere arricchite per la produzione di cellule CAR-T, e in definitiva può essere garantito un rapporto definito di cellule CD4 e CD8. Oltre alle differenze nel protocollo di espansione, le cellule CAR-T con differenti domini costimolatori intracellulari nei loro costrutti CAR presentavano proprietà di espansione e fenotipo diverse. Le lunghezze dei distanziali extracellulari CAR utilizzati sono fondamentali per la terapia cellulare CAR-T. È probabile che la formulazione di cellule CAR-T con una composizione definita di diversi sottoinsiemi possa migliorare l'uniformità dei prodotti CAR-T, che potrebbero essere utilizzati in ulteriori indagini per trarre conclusioni più definitive.
Ricaduta dopo terapia CAR-T
Sebbene le cellule CAR-T mirate al CD19 abbiano raggiunto un'efficace efficacia antitumorale nel trattamento delle neoplasie ematologiche, un numero considerevole di pazienti con CR ha recidivato dopo la terapia CAR-T. Sebbene il meccanismo di recidiva non sia stato completamente chiarito, si ritiene che la perdita di antigene e la scarsa persistenza della CAR-T contribuiscano alla ricaduta della malattia.
I tumori in una piccola percentuale di responder pediatrici e adulti sono ricaduti dopo il trattamento con cellule CAR-T CD19 a causa della delezione CD19 e della crescita delle cellule tumorali CD19, che risulta dalla resistenza acquisita alla terapia CAR-T a causa della fuga dell'antigene. Per prevenire il ripetersi del tumore, è necessaria una più ampia attivazione immunitaria per suscitare una seconda ondata di immunità oltre alla terapia con le cellule CAR-T355. Recentemente, sono stati segnalati altri nuovi meccanismi che spiegano la ricaduta delle neoplasie ematologiche dopo la terapia con cellule CAR-T CD19. Le molecole di CD19 sulle cellule tumorali trasdotte con vettori CAR possono essere mascherate dalle molecole CAR, portando alla loro fuga dall'attacco delle cellule CAR-T e al ripetersi di neoplasie. Un antigene bersaglio riconosciuto dalle cellule CAR-T sulle cellule tumorali può anche essere rimosso dalle cellule CAR-T attraverso la trogocitosi, con conseguente riduzione dell'antigene e del fratricida tra le cellule CAR-T Un altro ostacolo è la scarsa persistenza delle cellule CAR-T . L'efficacia della terapia cellulare CAR-T è strettamente correlata all'espansione e alla sopravvivenza in vivo delle cellule356. Molte strategie discusse sopra, compresa l'ottimizzazione del costrutto CAR e le strategie di precondizionamento e infusione, possono prolungare la sopravvivenza delle cellule CAR-T e migliorare la loro efficacia antitumorale.
Effetti collaterali
Le cellule CAR-T colpiscono l'antigene espresso sulla superficie delle cellule tumorali. Questo antigene è generalmente espresso su cellule normali e non esclusivamente su cellule tumorali. Le cellule CAR-T attaccano i tessuti normali quando si eliminano le cellule tumorali, causando effetti collaterali nei tessuti normali, che sono chiamati effetti collaterali "sul bersaglio, fuori dal tumore". Gli studi clinici in cui le cellule CAR-T infuse per la terapia del cancro hanno riconosciuto HER, CAIX, CD19 e mesotelina hanno mostrato danni ai tessuti normali. Molte strategie sono state sviluppate per migliorare la sicurezza della terapia cellulare CAR-T, come il targeting di altri antigeni, come il CD1a, al posto del CD19, dotando le cellule CAR-T di interruttori di sicurezza introducendo geni suicidi, esprimendo una CAR divisa molecola, costruzione di costrutti CAR inibitori o doppie cellule CAR-T attivate dall'antigene per riconoscere le cellule tumorali in modo più specifico e messa a punto dell'affinità dello scFv utilizzato per la costruzione CAR per minimizzare l'incidenza di gravi effetti avversi. Inoltre, l'iniezione locale di cellule CAR-T può anche ridurre gli effetti fuori bersaglio, poiché le cellule CAR-T sono limitate a livello regionale. Ulteriori ricerche potrebbero cercare di migliorare la sicurezza delle cellule CAR-T, in particolare per quanto riguarda la selezione dell'antigene CAR riconosciuto, lo sviluppo di cellule CAR-T controllabili e l'ottimizzazione delle strategie di infusione.
Tra gli effetti collaterali delle cellule CAR-T, il CRS è l'effetto avverso più comune. Il CRS derivante dalla terapia cellulare CAR-T CD19 è tollerabile se trattato correttamente. La CRS è indotta dalla robusta attivazione del sistema immunitario durante la terapia cellulare CAR-T, innescando il rilascio di un gran numero di citochine, tra cui IL-6, IL-10, IFN-y, TNF-α, GM-CSF e altre citochine e causando gravi effetti avversi. La gravità degli effetti collaterali correlati al CRS è strettamente correlata alla quantità di citochine rilasciate373, al carico tumorale e alla struttura del CAR272. mAb contro IL-6Ra (tocilizumab o sarilumab) sono usati per il trattamento della CRS oltre all'uso di corticosteroidi per inibire le reazioni infiammatorie152. Il blocco di IL-1β o TNF-α è un'altra strategia usata per trattare la CRS oltre a IL-6, ma i benefici per i pazienti devono ancora essere documentati. Le cellule CAR-T knockout per GM-CSF hanno determinato un'incidenza minima di CRS rispetto alle cellule CAR-T intatte GM-CSF372, indicando il ruolo chiave del GM-CSF derivato da CAR-T nel verificarsi di CRS.
Oltre alla CRS, si sono verificati vari gradi di neurotossicità a seguito dell'applicazione clinica della terapia cellulare CAR-T per il trattamento dei tumori ematologici. In effetti, la neurotossicità è sempre strettamente correlata alla CRS. La neurotossicità lieve è transitoria e reversibile. La comparsa di neurotossicità acuta e grave è solitamente accompagnata da gravi sintomi di CRS a causa della maggiore permeabilità della barriera emato-encefalica. Sebbene il meccanismo dell'incidenza della neurotossicità sia in gran parte sconosciuto, molti indizi hanno indicato che le citochine infiammatorie influenzano la funzione della barriera emato-encefalica e delle cellule endoteliali, contribuendo alla neurotossicità. Nei primati non umani, la neurotossicità mediata dalle cellule CAR-T è stata anche confermata associata alle citochine CSF proinfiammatorie e all'encefalite da cellule T-pan382. Per il trattamento della neurotossicità causata dalla terapia cellulare CAR-T, deve essere prescritto un regime che dipende dalla gravità. La terapia anti-IL-6 può invertire gli effetti collaterali nella fase iniziale. Per il trattamento della neurotossicità in fase avanzata, si raccomandano i corticosteroidi. I pazienti con stato epilettico non convulsivo e convulsivo devono essere trattati con benzodiazepine e altri antiepilettici.
Le cellule TCR-T colpiscono gli antigeni presentati dalle HLA sulle cellule tumorali. I potenziali effetti collaterali della terapia cellulare TCR-T sono ridotti rispetto a quelli della terapia cellulare CAR-T385. Tuttavia, è necessario prestare maggiore attenzione ai problemi di sicurezza quando si modificano l'affinità o altre caratteristiche del TCR. Le cellule TCR-T con affinità migliorata migliorano sempre il riconoscimento degli antigeni presentati dall'HLA, ma gli effetti collaterali di solito lo accompagnano. In uno studio pilota che utilizza la terapia TCR-T potenziata per l'affinità per il trattamento del melanoma e di altri tumori, due dei nove pazienti sono deceduti per leucoencefalopatia dopo il trattamento con cellule TCR-T ad alta affinità MAGE-3 a causa della tossicità fuori bersaglio. In un altro studio clinico per il trattamento del melanoma e del mieloma, due pazienti sono deceduti per cardiotossicità dopo terapia cellulare TCR-T specifica per MAGE-3, potenziata per affinità, principalmente a causa della reazione crociata con il peptide di titina, che è espresso nel tessuto cardiaco . Pertanto, è necessaria un'indagine meticolosa della terapia TCR-T potenziata per l'affinità prima che possa fornire beneficio clinico ai pazienti oncologici.
Prospettiva
Tra le immunoterapie del cancro, la terapia cellulare CAR-T ha mostrato una forte efficacia antitumorale per il trattamento delle neoplasie ematologiche. Dopo l'approvazione della terapia cellulare CAR-T per il trattamento della leucemia e del linfoma, un numero maggiore di pazienti sarà in grado di beneficiare di questa nuova terapia, ma gli effetti collaterali, le ricadute dopo la CR e il monitoraggio a lungo termine dovrebbero essere fonte di preoccupazione. La terapia cellulare CAR-T per i tumori solidi è tutt'altro che soddisfacente. Si dovrebbero compiere sforzi per superare l'immunosoppressione mediata dal microambiente dei tumori solidi. Le cellule TCR-T e altre cellule immunitarie geneticamente modificate hanno prodotto un'immunità efficace durante il trattamento del cancro in studi preclinici e clinici e dovrebbero essere compiuti sforzi per arruolare più pazienti per ottenere i benefici della terapia TCR-T. Si spera che presto arriverà un'altra svolta nella terapia delle cellule T ingegnerizzata per tumori.
Da:



Commenti
Posta un commento