How one woman became the exception to her family’s Alzheimer’s history / Come una donna è diventata l'eccezione alla storia della sua famiglia di Alzheimer
How one woman became the exception to her family’s Alzheimer’s history / Come una donna è diventata l'eccezione alla storia della sua famiglia di Alzheimer
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
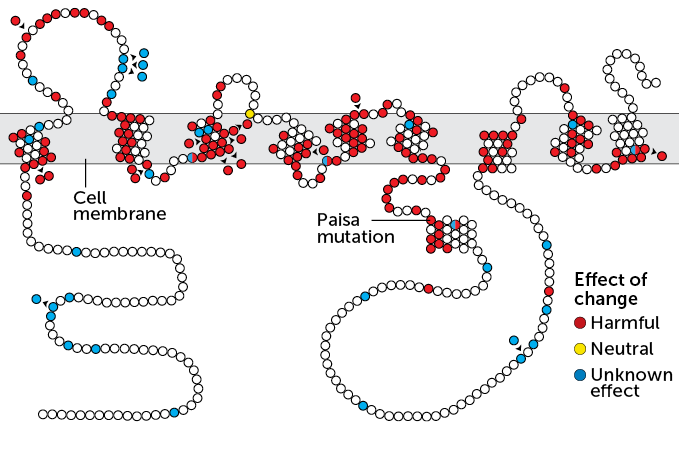
The presenilin 1 protein spans cell membranes and helps chop a long protein into amyloid-beta and other bits. Researchers know of about 300 genetic mutations that alter the protein’s amino acids (circles; colors show changes). The Paisa mutation leads to early onset Alzheimer’s.
Their story may point to new ways to stop the memory-robbing disease.
A cruel twist of genetic fate brought Alzheimer’s disease to a sprawling Colombian family. But thanks to a second twist, one member of the clan, a woman, managed to evade the symptoms for decades. Her escape may hold the key to halting, or even preventing, Alzheimer’s.
The inherited version of Alzheimer’s disease erodes people’s memories early, starting around age 40. In this family and others, a mutation in a gene called presenilin 1 eventually leaves its carriers profoundly confused and unable to care for themselves. Locals around the Colombian city of Medellín have a name for the condition: la bobera, or “the foolishness.”
The woman in the afflicted family who somehow fended off the disease carried the same mutation that usually guarantees dementia. And her brain was filled with plaques formed by a sticky protein called amyloid. Many scientists view that accumulation as one of the earliest signs of the disease. Yet she stayed sharp until her 70s.
Researchers were stumped, until they discovered that the woman also carried another, extremely rare genetic mutation that seemed to be protecting her from the effects of the first one. This second mutation, in a different Alzheimer’s-related gene called APOE, seemed to slow the disease down by decades, says Joseph Arboleda-Velasquez, a cell biologist at Harvard Medical School.
“There was this idea of inevitability,” he says. But the woman’s circumstances bring “a different perspective” — one in which amyloid buildup no longer guarantees problems. Arboleda-Velasquez and colleagues reported the details of the woman’s exceptional case November 4 in Nature Medicine, omitting the woman’s name and precise age to protect her privacy.
Although the discovery is based on one person, it points to a biological weak spot in the degenerative disease that affects an estimated 5.8 million people in the United States alone. So far, nearly every clinical trial designed to slow or stop the disease has failed. Those heartbreaking disappointments have prompted scientists to expand their search for treatments.
Perhaps this unusually resilient woman in Colombia shows a way to halt the disease, or at least slow it down. “Can we come up with a drug that does this to people who don’t have a mutation?” asks Arboleda-Velasquez. “The potential for that is tremendous.”
Family tree
The vast majority of people with Alzheimer’s have a sporadic form of the disease with no clear genetic culprit. These people often reach their 70s or 80s before signs of dementia appear. Mutations that cause trouble much earlier, such as the Paisa mutation found in the Colombian family, are unusual. But despite their different origins and different timelines, these two versions of Alzheimer’s are thought to progress in somewhat similar ways.
Normally, presenilin 1 makes a protein that helps chop up the long, sticky amyloid precursor protein. One of the resulting small bits is called amyloid-beta. Those smaller pieces are harmlessly washed out of the brain. The mutated presenilin 1 gene found in the Colombian family, however, creates a kink in the chopping process that leads to an abundance of a version of amyloid that knits itself into plaques between brain cells.
This pileup is already visible in brain scans of people in their 20s who carry the mutation. By their mid-40s, many of these people have trouble remembering; they typically develop full-blown dementia by age 50.
Inheriting just one copy of the mutation is enough to lead to excess amyloid, and ultimately dementia. The mutation’s powerful effect in this family is “one of the strongest arguments for the fact that amyloid plays a critical role” in Alzheimer’s, says immunologist and aging expert Richard J. Hodes, director of the National Institute on Aging in Bethesda, Md. Since taking on the role in 1993, Hodes has helped set the course for U.S.-funded Alzheimer’s research, allocating support for promising projects, including studies happening in Colombia.
The Colombian family, 5,000 members strong, includes an estimated 1,000 or so people who carry the Paisa mutation in the presenilin 1 gene. Their involvement in the research has been invaluable. Access to hundreds of people known to be at high risk for the disease allows scientists to study how Alzheimer’s unfolds, particularly at its earliest stages, and has led to reports of early signs of Alzheimer’s, both in the brain and the blood. Family members have gone to great lengths to help, “walking or taking a bicycle to the nearest bus stop, and then taking a bus to a train, for many hours, to come to the clinic,” Hodes says.
During Hodes’ recent visit to the Medellín area, a resident told him how the disease is just a part of their lives: “If I have the disease, I know that my family, my brother and my sister, will take care of me. And if I don’t, I will take care of them.”
A unique brain
When Colombian researchers learned of the woman who stayed sharp until her 70s, they arranged for her to travel to Boston in the summer of 2016, accompanied by family members and a research assistant. There, neuroimaging researcher Yakeel T. Quiroz and her colleagues used brain scans to measure levels of amyloid and other markers of brain health, including another Alzheimer’s-related protein called tau, which can tangle up inside nerve cells.
Those scans revealed a brain loaded with amyloid, says Quiroz, of Harvard Medical School. This woman had most likely been accumulating amyloid for decades. On a scale commonly used to quantify amyloid in the brain, she scored 1.96, well above the threshold of 1.2 that signifies extensive amyloid buildup. Her score was, “pretty much the highest that we have seen in anybody we have scanned so far,” Quiroz says.
Genetic analyses revealed that the woman had what’s called the Christchurch mutation in both copies of her APOE gene. Further tests suggested that this mutation, named for the New Zealand city where it was first found, was shielding her from the disease. The fact that the woman had huge amounts of amyloid in her brain, yet didn’t seem impaired until her 70s, is “extremely surprising, interesting, provocative and potentially very, very informative,” Hodes says.
Scientists need to do more work to confirm that the APOE Christchurch mutation protected her brain. Still, the results reveal a simple truth, Hodes says. “Amyloid itself is not necessarily sufficient to cause dementia.”
Studies outside of the Colombian family also make clear that amyloid isn’t the whole story. Other cellular actors contribute to the death of nerve cells and memory loss that Alzheimer’s brings. Nerve cell–clogging tangles of tau and other signs of brain illness are tightly linked to brain decline, research from many studies has shown. That’s reflected in observations from a study of 480 people age 60 and older who live around Rochester, Minn.
These people, none of whom showed signs of dementia, were randomly chosen to be invited into the study, an unbiased selection that offered researchers a glimpse of brain health in the wider population.
To find out which brain changes best predict future memory loss, neuroradiologist Clifford R. Jack Jr. of the Mayo Clinic in Rochester and colleagues tested volunteers’ memory performance while measuring their amyloid levels and other brain signals. Amyloid seemed to be closely involved in memory decline over about five years — but only in the right context, the team reported in June 2019 in JAMA.
Without either of two other troublesome markers — tau tangles or brain shrinkage — amyloid didn’t predict memory loss. In other words, amyloid might be setting up the shot, but then it passes the ball.
Stretching the lag
“Amyloid in the head is the first stage of what will ultimately lead to full-blown Alzheimer’s disease,” Jack says. But there can be a lot of time between that early stage of amyloid accumulation and the development of symptoms.
Among the Colombian family members, that interval lasts around 10 to 15 years. The same is roughly true for people with the sporadic form of Alzheimer’s. But for the woman described in the report in Nature Medicine, that lag seemed twice as long.
“That suggests that at least it’s possible to live with amyloid not just for 15 years, but for many decades,” says Paul Aisen, director of the University of Southern California’s Alzheimer’s Therapeutic Research Institute in San Diego. Living healthy longer: “That’s very exciting.”
The protective effect of the woman’s mutation seems to come from an extremely specific change. In the Christchurch variant, a single spot in the APOE gene is tweaked. The resulting protein has a serine amino acid swapped in for the standard arginine.
The swap prevents the APOE protein from binding to some sugar-dotted proteins called heparan sulfate proteoglycans, or HSPGs, experiments on the isolated proteins revealed. Earlier studies showed that HSPGs may promote amyloid accumulation and nudge nerve cells to slurp up more toxic tau.
But to misbehave, HSPGs might need to partner with the APOE protein. The Christchurch mutation could have protected the woman’s brain by scrambling that nefarious relationship, the researchers suspect. Without that specific connection between APOE and HSPGs, “the disease process gets stalled,” Arboleda-Velasquez says. “This really puts a block on the cascade of events.”
Fleshing out the APOE protein’s normal biological cascade, and how that changes with the Christchurch mutation, is “going to allow for much more finely targeted drug development,” says Aisen, who also works as a consultant for Biogen, a biotechnology company in Cambridge, Mass. The company is developing an amyloid-targeting drug called aducanumab and is expected to apply for approval from the U.S. Food and Drug Administration this year (SN: 1/18/20, p. 8).
As one of the strongest genetic risk factors for dementia, the APOE gene has long been scrutinized as a possible target for Alzheimer’s drugs. People who carry a version of the gene called APOE4 have a higher risk of Alzheimer’s.
The APOE2 version dramatically lowers the risk, Quiroz, Arboleda-Velasquez and colleagues report in preliminary research posted online November 2 at medRxiv.org. APOE3 usually brings an average risk of Alzheimer’s, with the notable exception of the version with the Christchurch mutation carried by the Colombian woman.
Hope for the future
In the general population, old age is the biggest risk factor for Alzheimer’s. As the number of older people balloons, so too will the number of people with dementia. By 2050, an estimated 13.8 million people in the United States will have Alzheimer’s. Worldwide, an estimated 50 million people have dementia; Alzheimer’s accounts for the bulk of those cases.
The family in Colombia continues to help. A clinical trial testing a drug that is designed to lower amyloid is under way in Colombia. People who have the Paisa mutation but have not shown Alzheimer’s symptoms, as well as people without the mutation, are receiving the drug. The drug, crenezumab, is an antibody that’s thought to mark amyloid for destruction by immune cells. It’s being developed by Roche/Genentech.
Quiroz and her colleagues also plan to follow the Colombian woman and other members of the family over time, as part of a research exchange between Fundación Universidad de Antioquia in Medellín, which has led the studies on this family, and Massachusetts General Hospital in Boston.
Each month, the project, called COLBOS, for Colombia-Boston, flies a new group of about five adult participants to Boston for extensive evaluation, including thinking and memory tests, brain scans and measurements of smelling ability, fitness and music perception. Participants being studied in Colombia are as young as 9 years old.
The project may yield insights about how Alzheimer’s takes hold early on. But in a way, the initial trigger might not even matter. It could be that the cause — or more likely, causes — of Alzheimer’s might ultimately be poor targets for drugs, Arboleda-Velasquez says.
People with loved ones suffering from Alzheimer’s, including the Colombian family, don’t necessarily care what causes the disease, Quiroz says. “They are more interested in seeing if there is anything that can help them to get better. That’s what the patients and families are waiting for.”
ITALIANO
La proteina presenilina 1 attraversa le membrane cellulari e aiuta a tagliare una lunga proteina in beta-amiloide e altri bit. I ricercatori conoscono circa 300 mutazioni genetiche che alterano gli aminoacidi della proteina (cerchi; i colori mostrano cambiamenti). La mutazione Paisa porta all'Alzheimer a esordio precoce.
La loro storia potrebbe indicare nuovi modi per fermare la malattia da furto della memoria.
Una svolta crudele del destino genetico ha portato la malattia di Alzheimer in una famiglia colombiana tentacolare. Ma grazie a una seconda svolta, un membro del clan, una donna, è riuscito a sfuggire ai sintomi per decenni. La sua fuga può contenere la chiave per fermare o addirittura prevenire l'Alzheimer.
La versione ereditaria della malattia di Alzheimer erode presto i ricordi delle persone, a partire dai 40 anni circa. In questa famiglia e in altri, una mutazione in un gene chiamato presenilina 1 alla fine lascia i suoi portatori profondamente confusi e incapaci di prendersi cura di se stessi. I locali intorno alla città colombiana di Medellín hanno un nome per la condizione: la bobera, o "la follia".
La donna della famiglia afflitta che in qualche modo ha respinto la malattia portava la stessa mutazione che di solito garantisce la demenza. E il suo cervello era pieno di placche formate da una proteina appiccicosa chiamata amiloide. Molti scienziati ritengono che l'accumulo sia uno dei primi segni della malattia. Eppure rimase acuta fino ai suoi anni '70.
I ricercatori sono rimasti sconcertati, fino a quando non hanno scoperto che la donna portava anche un'altra, estremamente rara mutazione genetica che sembrava proteggerla dagli effetti della prima. Questa seconda mutazione, in un diverso gene correlato all'Alzheimer chiamato APOE, sembrava rallentare la malattia di decenni, afferma Joseph Arboleda-Velasquez, un biologo cellulare della Harvard Medical School.
"C'era questa idea di inevitabilità", dice. Ma le circostanze della donna portano "una prospettiva diversa" - una in cui l'accumulo di amiloide non garantisce più problemi. Arboleda-Velasquez e colleghi hanno riferito i dettagli del caso eccezionale della donna del 4 novembre in Nature Medicine, omettendo il nome della donna e l'età precisa per proteggere la sua privacy.
Sebbene la scoperta si basi su una persona, indica un punto debole biologico nella malattia degenerativa che colpisce circa 5,8 milioni di persone nei soli Stati Uniti. Finora, quasi tutti gli studi clinici progettati per rallentare o arrestare la malattia sono falliti. Quelle delusioni strazianti hanno spinto gli scienziati a espandere la loro ricerca di trattamenti.
Forse questa donna insolitamente resistente in Colombia mostra un modo per fermare la malattia, o almeno per rallentarla. "Possiamo proporre un farmaco che lo faccia alle persone che non hanno una mutazione?" Chiede Arboleda-Velasquez. "Il potenziale per questo è eccezionale."
Albero genealogico
La stragrande maggioranza delle persone con Alzheimer ha una forma sporadica della malattia senza un chiaro colpevole genetico. Queste persone raggiungono spesso i loro anni '70 o '80 prima che compaiano segni di demenza. Le mutazioni che causano problemi molto prima, come la mutazione Paisa trovata nella famiglia colombiana, sono insolite. Ma nonostante le loro origini diverse e le diverse scadenze, si ritiene che queste due versioni dell'Alzheimer progrediscano in modo un po 'simile.
Normalmente, la presenilina 1 produce una proteina che aiuta a tagliare la proteina precursore dell'amiloide lunga e appiccicosa. Uno dei piccoli bit risultanti si chiama beta-amiloide. Quei pezzi più piccoli vengono lavati innocuamente dal cervello. Il gene mutato della presenilina 1 trovato nella famiglia colombiana, tuttavia, crea un nodo nel processo di trinciatura che porta a un'abbondanza di una versione di amiloide che si trasforma in placche tra le cellule cerebrali.
Questo accumulo è già visibile nelle scansioni cerebrali di persone ventenni portatrici della mutazione. Verso la metà degli anni '40, molte di queste persone hanno difficoltà a ricordare; in genere sviluppano demenza conclamata all'età di 50 anni.
Ereditare solo una copia della mutazione è sufficiente per portare ad un eccesso di amiloide e, infine, alla demenza. Il potente effetto della mutazione in questa famiglia è "uno degli argomenti più forti per il fatto che l'amiloide svolge un ruolo critico" nell'Alzheimer, afferma l'immunologo ed esperto di invecchiamento Richard J. Hodes, direttore del National Institute on Aging di Bethesda, Md. assumendo il ruolo nel 1993, Hodes ha contribuito a preparare la strada per la ricerca sull'Alzheimer, finanziata dagli Stati Uniti, assegnando il sostegno a progetti promettenti, compresi gli studi in corso in Colombia.
La famiglia colombiana, composta da 5.000 membri, comprende circa 1.000 persone circa che portano la mutazione Paisa nel gene della presenilina 1. Il loro coinvolgimento nella ricerca è stato inestimabile. L'accesso a centinaia di persone note per essere ad alto rischio per la malattia consente agli scienziati di studiare come si sviluppa l'Alzheimer, in particolare nelle sue prime fasi, e ha portato a segnalazioni di primi segni dell'Alzheimer, sia nel cervello che nel sangue. I familiari hanno fatto di tutto per aiutare, "camminando o prendendo una bicicletta fino alla fermata dell'autobus più vicina, e poi prendendo un autobus per un treno, per molte ore, per venire in clinica", dice Hodes.
Durante la recente visita di Hodes nell'area di Medellín, un residente gli ha detto che la malattia è solo una parte della loro vita: “Se ho la malattia, so che la mia famiglia, mio fratello e mia sorella, si prenderanno cura di me. E se non lo farò, mi prenderò cura di loro ".
Un cervello unico
Quando i ricercatori colombiani sono venuti a conoscenza della donna che è rimasta acuta fino ai suoi anni '70, le hanno organizzato un viaggio a Boston nell'estate del 2016, accompagnata da familiari e un assistente di ricerca. Lì, la ricercatrice di neuroimaging Yakeel T. Quiroz e i suoi colleghi hanno usato le scansioni del cervello per misurare i livelli di amiloide e altri marker di salute del cervello, tra cui un'altra proteina correlata all'Alzheimer chiamata tau, che può aggrovigliarsi all'interno delle cellule nervose.
Quelle scansioni hanno rivelato un cervello carico di amiloide, dice Quiroz, della Harvard Medical School. Molto probabilmente questa donna aveva accumulato amiloide per decenni. Su una scala comunemente usata per quantificare l'amiloide nel cervello, ha segnato 1,96, ben al di sopra della soglia di 1,2 che indica un ampio accumulo di amiloide. Il suo punteggio è stato, "praticamente il più alto che abbiamo visto in chiunque abbiamo scannerizzato finora", dice Quiroz.
Le analisi genetiche hanno rivelato che la donna aveva quella che viene chiamata la mutazione di Christchurch in entrambe le copie del suo gene APOE. Ulteriori test hanno suggerito che questa mutazione, chiamata per la città della Nuova Zelanda dove fu trovata per la prima volta, la stava proteggendo dalla malattia. Il fatto che la donna avesse un'enorme quantità di amiloide nel cervello, ma non sembrava compromessa fino ai suoi 70 anni, è "estremamente sorprendente, interessante, provocatorio e potenzialmente molto, molto informativo", dice Hodes.
Gli scienziati devono fare più lavoro per confermare che la mutazione APOE Christchurch ha protetto il suo cervello. Tuttavia, i risultati rivelano una semplice verità, dice Hodes. "L'amiloide stessa non è necessariamente sufficiente per causare la demenza."
Studi al di fuori della famiglia colombiana chiariscono anche che l'amiloide non è l'intera storia. Altri attori cellulari contribuiscono alla morte delle cellule nervose e alla perdita di memoria causata dall'Alzheimer. I grovigli di tau intasamento delle cellule nervose e altri segni di malattia del cervello sono strettamente collegati al declino del cervello, la ricerca di molti studi ha dimostrato. Ciò si riflette nelle osservazioni di uno studio su 480 persone di 60 anni e più che vivono intorno a Rochester, Minn.
Queste persone, nessuna delle quali ha mostrato segni di demenza, sono state scelte casualmente per essere invitate allo studio, una selezione imparziale che ha offerto ai ricercatori un assaggio della salute del cervello nella popolazione più ampia.
Per scoprire quali cambiamenti cerebrali predicono meglio la perdita di memoria futura, il neuroradiologo Clifford R. Jack Jr. della Mayo Clinic di Rochester e colleghi hanno testato le prestazioni della memoria dei volontari misurando i loro livelli di amiloide e altri segnali cerebrali. L'amiloide sembrava essere strettamente coinvolto nel declino della memoria per circa cinque anni - ma solo nel giusto contesto, il team ha riferito a giugno 2019 a JAMA.
Senza nessuno degli altri due fastidiosi marker - grovigli di tau o restringimento del cervello - l'amiloide non ha previsto la perdita di memoria. In altre parole, l'amiloide potrebbe impostare il tiro, ma poi passa la palla.
Allungando il ritardo
"L'amiloide nella testa è il primo stadio di ciò che alla fine porterà alla vera malattia di Alzheimer", afferma Jack. Ma ci può essere molto tempo tra quella fase iniziale dell'accumulo di amiloide e lo sviluppo dei sintomi.
Tra i membri della famiglia colombiana, tale intervallo dura dai 10 ai 15 anni. Lo stesso è approssimativamente vero per le persone con la forma sporadica di Alzheimer. Ma per la donna descritta nel rapporto su Nature Medicine, quel ritardo sembrava il doppio del tempo.
"Ciò suggerisce che almeno è possibile vivere con l'amiloide non solo per 15 anni, ma per molti decenni", afferma Paul Aisen, direttore dell'Istituto di ricerca terapeutica Alzheimer della University of Southern California a San Diego. Vivere in salute più a lungo: "È molto eccitante".
L'effetto protettivo della mutazione della donna sembra provenire da un cambiamento estremamente specifico. Nella variante di Christchurch, viene modificato un singolo punto del gene APOE. La proteina risultante ha un amminoacido serinico sostituito con l'arginina standard.
Lo scambio impedisce alla proteina APOE di legarsi ad alcune proteine punteggiate di zucchero chiamate proteoglicani eparan solfato, o HSPG, rivelando esperimenti sulle proteine isolate. Studi precedenti hanno dimostrato che gli HSPG possono promuovere l'accumulo di amiloide e spingere le cellule nervose per assorbire tau più tossica.
Ma per comportarsi male, gli HSPG potrebbero aver bisogno di collaborare con la proteina APOE. La mutazione di Christchurch avrebbe potuto proteggere il cervello della donna confondendo quella relazione nefasta, sospettano i ricercatori. Senza quella specifica connessione tra APOE e HSPG, "il processo della malattia si blocca", afferma Arboleda-Velasquez. "Questo mette davvero un blocco sulla cascata di eventi."
Eliminare la normale cascata biologica della proteina APOE e come ciò cambia con la mutazione di Christchurch, "consentirà uno sviluppo di farmaci molto più mirato", afferma Aisen, che lavora anche come consulente per Biogen, una società di biotecnologie a Cambridge, Mass. La società sta sviluppando un farmaco mirato all'amiloide chiamato aducanumab e dovrebbe presentare domanda di approvazione da parte della Food and Drug Administration americana quest'anno (SN: 1/18/20, p. 8).
Come uno dei più forti fattori di rischio genetico per la demenza, il gene APOE è stato a lungo esaminato come possibile bersaglio per i farmaci per l'Alzheimer. Le persone che portano una versione del gene chiamato APOE4 hanno un rischio maggiore di Alzheimer.
La versione APOE2 riduce drasticamente il rischio, secondo Quiroz, Arboleda-Velasquez e i colleghi nelle ricerche preliminari pubblicate online il 2 novembre su medRxiv.org. APOE3 di solito comporta un rischio medio di Alzheimer, con la notevole eccezione della versione con la mutazione di Christchurch portata dalla donna colombiana.
Speranza per il futuro
Nella popolazione generale, la vecchiaia è il principale fattore di rischio per l'Alzheimer. Con l'aumentare del numero di persone anziane, aumenta anche il numero di persone con demenza. Entro il 2050, circa 13,8 milioni di persone negli Stati Uniti avranno il morbo di Alzheimer. In tutto il mondo, si stima che 50 milioni di persone soffrano di demenza; I conti di Alzheimer rappresentano la maggior parte di questi casi.
La famiglia in Colombia continua ad aiutare. In Colombia è in corso uno studio clinico per testare un farmaco progettato per ridurre l'amiloide. Le persone che hanno la mutazione Paisa ma non hanno mostrato i sintomi dell'Alzheimer, così come le persone senza la mutazione, stanno ricevendo il farmaco. Il farmaco, il crenezumab, è un anticorpo che è stato pensato per contrassegnare l'amiloide per la distruzione da parte delle cellule immunitarie. È stato sviluppato da Roche / Genentech.
Quiroz e i suoi colleghi hanno anche in programma di seguire nel tempo la donna colombiana e altri membri della famiglia, nell'ambito di uno scambio di ricerche tra la Fundación Universidad de Antioquia di Medellín, che ha condotto gli studi su questa famiglia e il Massachusetts General Hospital di Boston.
Ogni mese, il progetto, chiamato COLBOS, per Colombia-Boston, porta a Boston un nuovo gruppo di circa cinque partecipanti adulti per una valutazione approfondita, inclusi test di pensiero e di memoria, scansioni del cervello e misurazioni di capacità di sentire l'odore, fitness e percezione musicale. I partecipanti che studiano in Colombia hanno solo 9 anni.
Il progetto potrebbe fornire approfondimenti su come l'Alzheimer prende piede presto. Ma in un certo senso, l'innesco iniziale potrebbe non avere importanza. Potrebbe essere che la causa - o più probabilmente, le cause - del morbo di Alzheimer potrebbero essere in definitiva cattivi obiettivi per i farmaci, afferma Arboleda-Velasquez.
Le persone con persone care che soffrono di Alzheimer, compresa la famiglia colombiana, non si preoccupano necessariamente di ciò che provoca la malattia, dice Quiroz. “Sono più interessati a vedere se c'è qualcosa che possa aiutarli a migliorare. Questo è ciò che i pazienti e le famiglie stanno aspettando ".
Da:



Commenti
Posta un commento