Stem-like CD8+ T cells cozy up within tumors before launching an attack / Le cellule T CD8 + simili a staminali si addensano nei tumori prima di lanciare un attacco
Stem-like CD8+ T cells cozy up within tumors before launching an attack / Le cellule T CD8 + simili a staminali si addensano nei tumori prima di lanciare un attacco
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
Since the infiltration of CD8+ T cells into tumors predicts survival and response to immunotherapy in many patients, Jansen et al. examined the CD8+ T cell response against human cancer in order to understand why some tumors have high CD8+
T cell infiltration while others do not, and to uncover the mechanisms
behind the antitumor T cell response. The results, recently published in
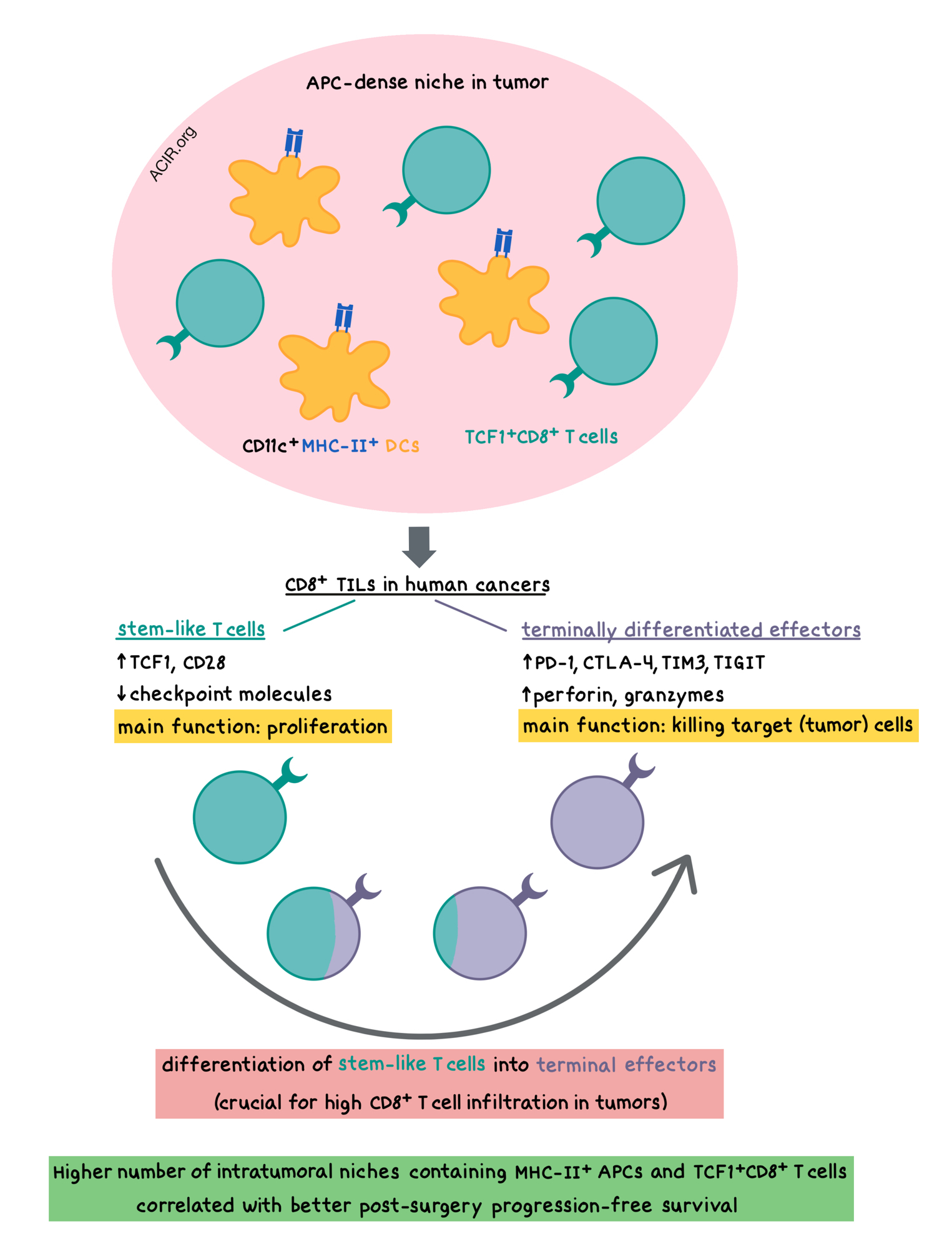
Nature, indicate that high CD8+ T cell infiltration depends on the ability of stem-like CD8+ T cells – residing within antigen-presenting niches in the tumor – to generate terminally differentiated effector T cells.
The researchers began by collecting tumor tissue from 68 patients with kidney cancer and measuring intratumoral CD8+ T cell infiltration by flow cytometry. CD8+ T cell infiltration ranged from 0.02% to more than 20% of total tumor cells, and did not correlate with clinical parameters (patient age, disease stage, and other typically used patient grading systems). Patients who had CD8+ T cell infiltration below 2.2% tended to have much more rapid progression after surgery compared to patients with a higher percentage of tumor-infiltrating CD8+ lymphocytes (TILs).
TIL composition analysis revealed one subset of cells that resembled exhausted CD8+ T cells, with high expression of checkpoint molecules, including PD-1, CTLA-4, TIM3, and TIGIT; and another subset of TILs with low levels of checkpoint molecules and high expression of the costimulatory CD28 molecule, as well as the transcription factor TCF1, which is associated with a stem-like T cell population in chronic viral infections. Upon in vitro stimulation, the stem-like TCF1+TIM3-CD28+ T cells isolated from tumors consistently proliferated, while the checkpoint-high PD-1+TIM3+ T cells did not. After proliferating, the stem-like cells upregulated PD-1, TIM3, and CD244, and downregulated TCF1, indicating their ability to differentiate into terminal effector-like T cells. Confirming this, TCR repertoire analysis showed significant clonal overlap between the two populations.
In poorly infiltrated kidney, bladder, and prostate tumors, the stem-like CD8+ T cells were present in very low numbers, but rarely were accompanied by the presence of terminally differentiated, exhausted-like cells. In contrast, highly infiltrated tumors had a significant presence of the terminally differentiated TIM3+ cells. These observations suggest that the magnitude of the intratumoral T cell response depends on the ability of the stem-like T cells to generate terminally differentiated T cells.
Exploring this hypothesis, the researchers utilized RNAseq and showed that the terminally differentiated T cells expressed elevated levels of checkpoint molecules as well as perforin and granzymes. The stem-like cells had increased levels of costimulatory molecules (e.g. CD28, CD226, CD2) and survival-related genes (e.g. IL7R, IL2RA [encoding CD25]). Whole-genome DNA methylation analysis revealed major epigenetic changes, primarily demethylation, and confirmed that the main function of the stem-like TILs was to proliferate, while the main function of the terminally differentiated TILs was to kill target cells. This compartmentalization of functions was regulated by distinct transcriptional and epigenetic programs.
Given the surprising localization of stem-like T cells within the tumors (studies in chronically-infected mice showed that such cells were present only in lymphoid tissue), Jansen et al. hypothesized that a lymphoid-like microenvironment might exist within the tumors that would support survival of these T cells. Analysis of the intratumoral antigen-presenting cells (APCs) across kidney, prostate, and bladder tumors revealed a highly significant correlation between the presence of CD11c+MHC-II+ dendritic cells and the number of stem-like CD8+ T cells. There was no correlation between macrophages and stem-like CD8+ T cells. Immunofluorescence staining demonstrated that the stem-like TCF1+CD8+ T cells tended to preferentially reside in APC-dense niches within the tumor, while TCF1-CD8+ T cells were distributed throughout the tumor. These niches were predominantly located inside the stromal barrier of the tumor, and they resembled the T cell zones of lymphoid tissues. Moreover, the presence of these niches was correlated to increased levels of lymphatic and blood vessels in the tumor. In contrast, the presence of tertiary lymphoid structures, which were observed primarily outside the tumor border, did not correlate with overall CD8+ T cell infiltration.
Finally, to understand tumor immune escape, the researchers imaged tumor tissue that was surgically removed from 26 patients with kidney cancer. They found that patients whose disease was controlled after surgery had a significantly higher number of niches containing MHC-II+ APCs and TCF1+CD8+ T cells compared to patients with poor progression-free survival (a >10-fold difference in niche numbers among the Stage III patients). The prognostic effect of APC niches was independent of tumoral expression of PD-L1, which did not correlate with TIL levels or patient survival.
Together, this high-resolution quantitative and spatial snapshot of multiple tumors with known clinical outcomes suggests that tumors may escape CD8+ T cell-mediated destruction either by preventing the formation of intratumoral APC niches or by destroying such niches. Furthermore, the impaired T cell response in some human cancers may be due not to the accumulation of exhausted CD8+ T cells or tumoral PD-L1 expression, but due to inefficient stimulation of stem-like CD8+ T cells within intratumoral APC niches, and the resulting failure to generate sufficient numbers of terminally differentiated CD8+ T cells in the tumor.
ITALIANO
Poiché l'infiltrazione delle cellule T CD8 + nei tumori prevede la sopravvivenza e la risposta all'immunoterapia in molti pazienti, Jansen et al. hanno esaminato la risposta delle cellule T CD8 + contro il cancro umano al fine di capire perché alcuni tumori hanno un'alta infiltrazione di cellule T CD8 + mentre altri no e di scoprire i meccanismi alla base della risposta delle cellule T antitumorale. I risultati, recentemente pubblicati su Nature, indicano che un'alta infiltrazione di cellule T CD8 + dipende dalla capacità delle cellule T CD8 + di tipo staminale - che risiedono all'interno di nicchie presentanti antigene nel tumore - di generare cellule T effettrici differenziate terminalmente.
I ricercatori hanno iniziato raccogliendo tessuto tumorale da 68 pazienti con carcinoma renale e misurando l'infiltrazione intratumorale di cellule T CD8 + mediante citometria a flusso. L'infiltrazione di cellule T CD8 + variava dallo 0,02% a oltre il 20% delle cellule tumorali totali e non era correlata ai parametri clinici (età del paziente, stadio della malattia e altri sistemi di classificazione dei pazienti generalmente utilizzati). I pazienti con infiltrazione di cellule T CD8 + al di sotto del 2,2% tendevano ad avere una progressione molto più rapida dopo l'intervento chirurgico rispetto ai pazienti con una percentuale più alta di linfociti CD8 + infiltranti il tumore (TIL).
L'analisi della composizione TIL ha rivelato un sottoinsieme di cellule che assomigliavano a cellule T CD8 + esauste, con alta espressione di molecole di checkpoint, tra cui PD-1, CTLA-4, TIM3 e TIGIT; e un altro sottogruppo di TIL con bassi livelli di molecole di checkpoint e alta espressione della molecola costimolatoria CD28, nonché il fattore di trascrizione TCF1, che è associato a una popolazione di cellule T simile allo stelo nelle infezioni virali croniche. Al momento della stimolazione in vitro, le cellule T TCF1 + TIM3-CD28 + simili a staminali isolate dai tumori proliferavano costantemente, mentre le cellule T PD-1 + TIM3 + T-point-point elevate non lo facevano. Dopo la proliferazione, le cellule simili a staminali hanno sovraregolato PD-1, TIM3 e CD244 e downregulate TCF1, indicando la loro capacità di differenziarsi in cellule T terminali simili a effettori. A conferma di ciò, l'analisi del repertorio TCR ha mostrato una significativa sovrapposizione clonale tra le due popolazioni.
Nei tumori del rene, della vescica e della prostata scarsamente infiltrati, le cellule T CD8 + simili a staminali erano presenti in numero molto basso, ma raramente erano accompagnate dalla presenza di cellule simili a esaurimento, differenziate terminalmente. Al contrario, i tumori altamente infiltrati presentavano una presenza significativa delle cellule TIM3 + terminalmente differenziate. Queste osservazioni suggeriscono che l'entità della risposta intratumorale delle cellule T dipende dalla capacità delle cellule T simil-staminali di generare cellule T differenziate terminalmente.
Esplorando questa ipotesi, i ricercatori hanno utilizzato RNAseq e hanno dimostrato che le cellule T differenziate in modo terminale esprimevano livelli elevati di molecole di checkpoint, oltre a perforina e granzimi. Le cellule staminali avevano livelli aumentati di molecole costimolatorie (ad esempio CD28, CD226, CD2) e geni correlati alla sopravvivenza (ad esempio IL7R, IL2RA [codificando CD25]). L'analisi della metilazione del DNA dell'intero genoma ha rivelato importanti cambiamenti epigenetici, principalmente la demetilazione, e ha confermato che la funzione principale delle TIL simil-staminali era quella di proliferare, mentre la funzione principale delle TIL differenziate terminalmente era uccidere le cellule bersaglio. Questa compartimentazione delle funzioni era regolata da distinti programmi trascrizionali ed epigenetici.
Data la sorprendente localizzazione delle cellule T simili a staminali all'interno dei tumori (studi su topi con infezione cronica hanno mostrato che tali cellule erano presenti solo nel tessuto linfoide), Jansen et al. hanno ipotizzato che all'interno dei tumori potrebbe esistere un microambiente simile a un linfoide che sostenga la sopravvivenza di queste cellule T. L'analisi delle cellule intratumorali presentanti l'antigene (APC) su tumori renali, prostatici e della vescica ha rivelato una correlazione molto significativa tra la presenza di cellule dendritiche CD11c + MHC-II + e il numero di cellule T CD8 + simili a staminali. Non c'era correlazione tra macrofagi e cellule T CD8 + simili a staminali. La colorazione di immunofluorescenza ha dimostrato che le cellule T TCF1 + CD8 + simili allo stelo tendevano a risiedere preferenzialmente nelle nicchie dense di APC all'interno del tumore, mentre le cellule T TCF1-CD8 + erano distribuite in tutto il tumore. Queste nicchie erano situate prevalentemente all'interno della barriera stromale del tumore e assomigliavano alle zone delle cellule T dei tessuti linfoidi. Inoltre, la presenza di queste nicchie era correlata all'aumento dei livelli di vasi linfatici e sanguigni nel tumore. Al contrario, la presenza di strutture linfoidi terziarie, che sono state osservate principalmente al di fuori del confine del tumore, non era correlata con l'infiltrazione globale di cellule T CD8 +.
Infine, per comprendere la fuga immunitaria del tumore, i ricercatori hanno analizzato il tessuto tumorale rimosso chirurgicamente da 26 pazienti con carcinoma renale.
Hanno scoperto che i pazienti la cui malattia era controllata dopo l'intervento chirurgico avevano un numero significativamente più elevato di nicchie contenenti MHC-II + APC e cellule T TCF1 + CD8 + rispetto ai pazienti con scarsa sopravvivenza libera da progressione (una differenza> 10 volte nei numeri di nicchia nello stadio III pazienti). L'effetto prognostico delle nicchie APC era indipendente dall'espressione tumorale di PD-L1, che non era correlata ai livelli di TIL o alla sopravvivenza del paziente.
Insieme, questa istantanea quantitativa e spaziale ad alta risoluzione di tumori multipli con esiti clinici noti suggerisce che i tumori possono sfuggire alla distruzione mediata da cellule T CD8 + prevenendo la formazione di nicchie intratumorali di APC o distruggendo tali nicchie. Inoltre, la compromissione della risposta delle cellule T in alcuni tumori umani potrebbe non essere dovuta all'accumulo di cellule T CD8 + esauste o all'espressione tumorale di PD-L1, ma a causa di un'inefficiente stimolazione di cellule T CD8 + tipo staminali all'interno delle nicchie intratumorali di APC e la conseguente incapacità di generare un numero sufficiente di cellule T CD8 + terminali differenziate nel tumore.
Da:
https://acir.org/weekly-digests/2020/january/stem-like-cd8-t-cells-cozy-up-within-tumors-before-launching-an-attack
The researchers began by collecting tumor tissue from 68 patients with kidney cancer and measuring intratumoral CD8+ T cell infiltration by flow cytometry. CD8+ T cell infiltration ranged from 0.02% to more than 20% of total tumor cells, and did not correlate with clinical parameters (patient age, disease stage, and other typically used patient grading systems). Patients who had CD8+ T cell infiltration below 2.2% tended to have much more rapid progression after surgery compared to patients with a higher percentage of tumor-infiltrating CD8+ lymphocytes (TILs).
TIL composition analysis revealed one subset of cells that resembled exhausted CD8+ T cells, with high expression of checkpoint molecules, including PD-1, CTLA-4, TIM3, and TIGIT; and another subset of TILs with low levels of checkpoint molecules and high expression of the costimulatory CD28 molecule, as well as the transcription factor TCF1, which is associated with a stem-like T cell population in chronic viral infections. Upon in vitro stimulation, the stem-like TCF1+TIM3-CD28+ T cells isolated from tumors consistently proliferated, while the checkpoint-high PD-1+TIM3+ T cells did not. After proliferating, the stem-like cells upregulated PD-1, TIM3, and CD244, and downregulated TCF1, indicating their ability to differentiate into terminal effector-like T cells. Confirming this, TCR repertoire analysis showed significant clonal overlap between the two populations.
In poorly infiltrated kidney, bladder, and prostate tumors, the stem-like CD8+ T cells were present in very low numbers, but rarely were accompanied by the presence of terminally differentiated, exhausted-like cells. In contrast, highly infiltrated tumors had a significant presence of the terminally differentiated TIM3+ cells. These observations suggest that the magnitude of the intratumoral T cell response depends on the ability of the stem-like T cells to generate terminally differentiated T cells.
Exploring this hypothesis, the researchers utilized RNAseq and showed that the terminally differentiated T cells expressed elevated levels of checkpoint molecules as well as perforin and granzymes. The stem-like cells had increased levels of costimulatory molecules (e.g. CD28, CD226, CD2) and survival-related genes (e.g. IL7R, IL2RA [encoding CD25]). Whole-genome DNA methylation analysis revealed major epigenetic changes, primarily demethylation, and confirmed that the main function of the stem-like TILs was to proliferate, while the main function of the terminally differentiated TILs was to kill target cells. This compartmentalization of functions was regulated by distinct transcriptional and epigenetic programs.
Given the surprising localization of stem-like T cells within the tumors (studies in chronically-infected mice showed that such cells were present only in lymphoid tissue), Jansen et al. hypothesized that a lymphoid-like microenvironment might exist within the tumors that would support survival of these T cells. Analysis of the intratumoral antigen-presenting cells (APCs) across kidney, prostate, and bladder tumors revealed a highly significant correlation between the presence of CD11c+MHC-II+ dendritic cells and the number of stem-like CD8+ T cells. There was no correlation between macrophages and stem-like CD8+ T cells. Immunofluorescence staining demonstrated that the stem-like TCF1+CD8+ T cells tended to preferentially reside in APC-dense niches within the tumor, while TCF1-CD8+ T cells were distributed throughout the tumor. These niches were predominantly located inside the stromal barrier of the tumor, and they resembled the T cell zones of lymphoid tissues. Moreover, the presence of these niches was correlated to increased levels of lymphatic and blood vessels in the tumor. In contrast, the presence of tertiary lymphoid structures, which were observed primarily outside the tumor border, did not correlate with overall CD8+ T cell infiltration.
Finally, to understand tumor immune escape, the researchers imaged tumor tissue that was surgically removed from 26 patients with kidney cancer. They found that patients whose disease was controlled after surgery had a significantly higher number of niches containing MHC-II+ APCs and TCF1+CD8+ T cells compared to patients with poor progression-free survival (a >10-fold difference in niche numbers among the Stage III patients). The prognostic effect of APC niches was independent of tumoral expression of PD-L1, which did not correlate with TIL levels or patient survival.
Together, this high-resolution quantitative and spatial snapshot of multiple tumors with known clinical outcomes suggests that tumors may escape CD8+ T cell-mediated destruction either by preventing the formation of intratumoral APC niches or by destroying such niches. Furthermore, the impaired T cell response in some human cancers may be due not to the accumulation of exhausted CD8+ T cells or tumoral PD-L1 expression, but due to inefficient stimulation of stem-like CD8+ T cells within intratumoral APC niches, and the resulting failure to generate sufficient numbers of terminally differentiated CD8+ T cells in the tumor.
ITALIANO
Poiché l'infiltrazione delle cellule T CD8 + nei tumori prevede la sopravvivenza e la risposta all'immunoterapia in molti pazienti, Jansen et al. hanno esaminato la risposta delle cellule T CD8 + contro il cancro umano al fine di capire perché alcuni tumori hanno un'alta infiltrazione di cellule T CD8 + mentre altri no e di scoprire i meccanismi alla base della risposta delle cellule T antitumorale. I risultati, recentemente pubblicati su Nature, indicano che un'alta infiltrazione di cellule T CD8 + dipende dalla capacità delle cellule T CD8 + di tipo staminale - che risiedono all'interno di nicchie presentanti antigene nel tumore - di generare cellule T effettrici differenziate terminalmente.
I ricercatori hanno iniziato raccogliendo tessuto tumorale da 68 pazienti con carcinoma renale e misurando l'infiltrazione intratumorale di cellule T CD8 + mediante citometria a flusso. L'infiltrazione di cellule T CD8 + variava dallo 0,02% a oltre il 20% delle cellule tumorali totali e non era correlata ai parametri clinici (età del paziente, stadio della malattia e altri sistemi di classificazione dei pazienti generalmente utilizzati). I pazienti con infiltrazione di cellule T CD8 + al di sotto del 2,2% tendevano ad avere una progressione molto più rapida dopo l'intervento chirurgico rispetto ai pazienti con una percentuale più alta di linfociti CD8 + infiltranti il tumore (TIL).
L'analisi della composizione TIL ha rivelato un sottoinsieme di cellule che assomigliavano a cellule T CD8 + esauste, con alta espressione di molecole di checkpoint, tra cui PD-1, CTLA-4, TIM3 e TIGIT; e un altro sottogruppo di TIL con bassi livelli di molecole di checkpoint e alta espressione della molecola costimolatoria CD28, nonché il fattore di trascrizione TCF1, che è associato a una popolazione di cellule T simile allo stelo nelle infezioni virali croniche. Al momento della stimolazione in vitro, le cellule T TCF1 + TIM3-CD28 + simili a staminali isolate dai tumori proliferavano costantemente, mentre le cellule T PD-1 + TIM3 + T-point-point elevate non lo facevano. Dopo la proliferazione, le cellule simili a staminali hanno sovraregolato PD-1, TIM3 e CD244 e downregulate TCF1, indicando la loro capacità di differenziarsi in cellule T terminali simili a effettori. A conferma di ciò, l'analisi del repertorio TCR ha mostrato una significativa sovrapposizione clonale tra le due popolazioni.
Nei tumori del rene, della vescica e della prostata scarsamente infiltrati, le cellule T CD8 + simili a staminali erano presenti in numero molto basso, ma raramente erano accompagnate dalla presenza di cellule simili a esaurimento, differenziate terminalmente. Al contrario, i tumori altamente infiltrati presentavano una presenza significativa delle cellule TIM3 + terminalmente differenziate. Queste osservazioni suggeriscono che l'entità della risposta intratumorale delle cellule T dipende dalla capacità delle cellule T simil-staminali di generare cellule T differenziate terminalmente.
Esplorando questa ipotesi, i ricercatori hanno utilizzato RNAseq e hanno dimostrato che le cellule T differenziate in modo terminale esprimevano livelli elevati di molecole di checkpoint, oltre a perforina e granzimi. Le cellule staminali avevano livelli aumentati di molecole costimolatorie (ad esempio CD28, CD226, CD2) e geni correlati alla sopravvivenza (ad esempio IL7R, IL2RA [codificando CD25]). L'analisi della metilazione del DNA dell'intero genoma ha rivelato importanti cambiamenti epigenetici, principalmente la demetilazione, e ha confermato che la funzione principale delle TIL simil-staminali era quella di proliferare, mentre la funzione principale delle TIL differenziate terminalmente era uccidere le cellule bersaglio. Questa compartimentazione delle funzioni era regolata da distinti programmi trascrizionali ed epigenetici.
Data la sorprendente localizzazione delle cellule T simili a staminali all'interno dei tumori (studi su topi con infezione cronica hanno mostrato che tali cellule erano presenti solo nel tessuto linfoide), Jansen et al. hanno ipotizzato che all'interno dei tumori potrebbe esistere un microambiente simile a un linfoide che sostenga la sopravvivenza di queste cellule T. L'analisi delle cellule intratumorali presentanti l'antigene (APC) su tumori renali, prostatici e della vescica ha rivelato una correlazione molto significativa tra la presenza di cellule dendritiche CD11c + MHC-II + e il numero di cellule T CD8 + simili a staminali. Non c'era correlazione tra macrofagi e cellule T CD8 + simili a staminali. La colorazione di immunofluorescenza ha dimostrato che le cellule T TCF1 + CD8 + simili allo stelo tendevano a risiedere preferenzialmente nelle nicchie dense di APC all'interno del tumore, mentre le cellule T TCF1-CD8 + erano distribuite in tutto il tumore. Queste nicchie erano situate prevalentemente all'interno della barriera stromale del tumore e assomigliavano alle zone delle cellule T dei tessuti linfoidi. Inoltre, la presenza di queste nicchie era correlata all'aumento dei livelli di vasi linfatici e sanguigni nel tumore. Al contrario, la presenza di strutture linfoidi terziarie, che sono state osservate principalmente al di fuori del confine del tumore, non era correlata con l'infiltrazione globale di cellule T CD8 +.
Infine, per comprendere la fuga immunitaria del tumore, i ricercatori hanno analizzato il tessuto tumorale rimosso chirurgicamente da 26 pazienti con carcinoma renale.
Hanno scoperto che i pazienti la cui malattia era controllata dopo l'intervento chirurgico avevano un numero significativamente più elevato di nicchie contenenti MHC-II + APC e cellule T TCF1 + CD8 + rispetto ai pazienti con scarsa sopravvivenza libera da progressione (una differenza> 10 volte nei numeri di nicchia nello stadio III pazienti). L'effetto prognostico delle nicchie APC era indipendente dall'espressione tumorale di PD-L1, che non era correlata ai livelli di TIL o alla sopravvivenza del paziente.
Insieme, questa istantanea quantitativa e spaziale ad alta risoluzione di tumori multipli con esiti clinici noti suggerisce che i tumori possono sfuggire alla distruzione mediata da cellule T CD8 + prevenendo la formazione di nicchie intratumorali di APC o distruggendo tali nicchie. Inoltre, la compromissione della risposta delle cellule T in alcuni tumori umani potrebbe non essere dovuta all'accumulo di cellule T CD8 + esauste o all'espressione tumorale di PD-L1, ma a causa di un'inefficiente stimolazione di cellule T CD8 + tipo staminali all'interno delle nicchie intratumorali di APC e la conseguente incapacità di generare un numero sufficiente di cellule T CD8 + terminali differenziate nel tumore.
Da:
https://acir.org/weekly-digests/2020/january/stem-like-cd8-t-cells-cozy-up-within-tumors-before-launching-an-attack



Commenti
Posta un commento