SOTTOPOPOLAZIONI DI MACROFAGI POLMONARI UMANI / HUMAN PULMONARY MACROPHAGE SUBPOPULATIONS
SOTTOPOPOLAZIONI DI MACROFAGI POLMONARI UMANI / HUMAN PULMONARY MACROPHAGE SUBPOPULATIONS
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
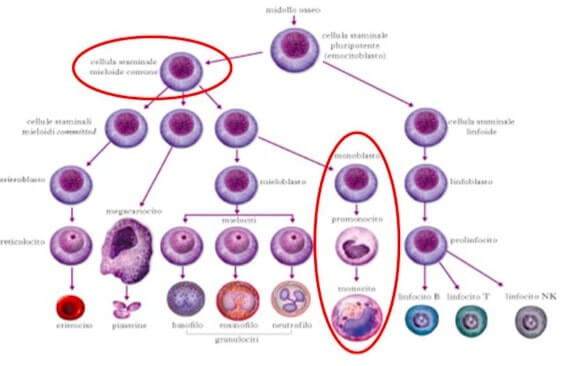
I macrofagi costituiscono i componenti maggiori del sistema dei fagociti mononucleati, (Mononucear Phagocyte System MPS), ed hanno una distribuzione ubiquitaria in diversi organi e tessuti. Oltre ai macrofagi tissutali, il sistema MPS include i monociti del sangue, le cellule dendritiche, gli osteoclasti, le cellule della microglia nel sistema nervoso centrale, le cellule di Kupffer nel fegato e le cellule di Langherans nella cute. Le cellule del sistema MPS costituiscono la prima linea di difesa nelle infezioni batteriche e virali e svolgono un ruolo primario nell’immunità naturale. Queste cellule sono, inoltre, in grado di regolare la risposta immune e svolgono un ruolo primario nel’induzione e nel mantenimento del processo infiammatorio.
Esse originano nel midollo osseo, probabilmente da un precursore mieloide comune CD34+ che da origine ai monociti del sangue. Successivamente, i monociti migrano in diversi tessuti dove si differenziano in cellule specializzate in seguito ad un’esposizione a diversi fattori microambientali. I macrofagi sono presenti virtualmente in tutti gli organi dove giocano un ruolo importante nelle risposte immuni ed infiammatorie locali, nel danno e nella riparazione tissutale, nella clearance delle cellule apoptotiche e nella sorveglianza antineoplastica. Anche se i macrofagi residenti nei vari tessuti presentano omologie morfologiche e funzionali, numerose evidenze suggeriscono che esiste una profonda eterogeneicità all’interno di questa popolazione cellulare. I macrofagi sono una popolazione cellulare ubiquitaria nell’uomo e sono responsabili di molteplici e fondamentali processi omeostatici, immunologici ed infiammatori .
La distribuzione in diversi organi e tessuti di tali cellule ne determina il ruolo centrale nella risposta ad agenti esterni (ad es. di tipo infettivo), nelle malattie autoimmuni e nel controllo della crescita neoplastica. Le cellule dendritiche, le cellule di Langerhans della cute, le cellule di Kupffer del fegato e le cellule della microglia nel sistema nervoso centrale (SNC) condividono con i macrofagi tessutali diverse caratteristiche morfologiche, biochimiche e funzionali.
Le specifiche caratteristiche funzionali di tali cellule sono:
1) la capacità di fagocitare microrganismi (ruolo chiave nell’immunità innata)
2) la capacità di processare antigeni e di presentarli ai linfociti T (ruolo chiave nell’immunità acquisita)
3) la sintesi di numerose citochine e chemochine in grado di iniziare e/o di amplificare o terminare la reazione infiammatoria, di promuovere il reclutamento di cellule infiammatorie e di modulare la risposta linfocitaria
4) la capacità di riconoscere e distruggere cellule neoplastiche. Numerose evidenze sperimentali indicano che i macrofagi tessutali e gli altri elementi cellulari specializzati derivino dai monociti circolanti
I monociti maturano nel midollo osseo e raggiungono, attraverso il circolo ematico, i diversi organi dove, attraverso l’esposizione a specifici fattori locali, si differenziano nei diversi tipi cellulari. È opportuno ricordare che una serie di osservazioni sperimentali suggerisce la possibilità che cellule della linea macrofagica possano svilupparsi anche da cellule staminali presenti in tessuti periferici. L’ipotesi della eterogeneità dei monociti e dei macrofagi è stata inizialmente peospettata sulla base di osservazioni al microscopio che avevano consentito di evidenziare la varietà morfologica di questi tipi cellulari. Tuttavia soltanto l’impiego di sistemi efficienti per l’isolamento di tali cellule dai tessuti periferici e lo sviluppo di metodiche adeguate per lo studio delle loro funzioni hanno permesso di identificare alcune specificità funzionali di queste cellule. Molteplici studi condotti negli ultimi anni nell’animale da esperimento hanno evidenziato significative differenze funzionali tra i macrofagi isolati da organi diversi. Ad esempio, i macrofagi alveolari del polmone sintetizzano maggiori quantità di citochine ed hanno una azione tumoricida più efficace rispetto ai macrofagi della cavità peritoneale. Al contrario, i macrofagi peritoneali hanno una maggiore capacità di fagocitosi, di attivazione del burst respiratorio e di produzione di ossido nitrico rispetto a quelli polmonari.
I macrofagi isolati dalla milza e dal timo esprimono particolarmente marcatori implicati nella presentazione dell’antigene e nella costimolazione dei linfociti T (HLA di classe II, CD 80 e CD86. Queste osservazioni suggeriscono che fattori locali ed il microambiente tessutale (ad es. fattori di crescita, citochine, stimoli esogeni) possano orientare lo sviluppo e la maturazione funzionale dei macrofagi verso l’attività prevalentemente richiesta in un determinato organo (ad es. difesa contro agenti infettivi, inizio o mantenimento di risposte immuni, sorveglianza tumorale). È opportuno sottolineare che la maggior parte delle osservazioni sulla eterogeneità dei macrofagi deriva da studi condotti nell’animale da esperimento. Questi dati, in molti casi, non sono estrapolabili ai macrofagi umani. Infatti, esistono sostanziali differenze nel profilo di mediatori proinfiammatori, nella espressione di recettori di membrana e nei meccanismi di attivazione dei macrofagi umani e di quelli degli animali da esperimento finora studiati (ratto e cavia).
Diverse osservazioni eseguite negli ultimi anni indicano un ulteriore livello di eterogeneità dei macrofagi isolati da uno stesso organo. Ad esempio, a livello polmonare, sono state descritte specificità funzionali per i macrofagi residenti nell’interstizio (macrofagi parenchimali) ed a livello alveolare. I primi possiedono caratteristiche fenotipiche (recettori di membrana) e biochimiche (produzione di citochine) orientate soprattutto verso l’interazione con i linfociti T e verso la sorveglianza anti-tumorale. I secondi presentano caratteristiche 8 orientate prevalentemente verso la risposta infiammatoria e verso il danno e la riparazione tessutale. Il polmone umano contiene inoltre una popolazione cellulare altamente differenziata costituita dalle cellule dendritiche . Queste cellule sono cellule particolarmente specializzate nella processazione e presentazione di antigeni ai linfociti T. Le cellule dendritiche si ritiene derivino dagli stessi precursori dei macrofagi tissutali (monociti circolanti), si differenziano negli organi periferici e, una volta incontrato l'antigene, migrano nei linfonodi loco-regionali per iniziare la risposta immune specifica attraverso l’interazione con linfociti T.
I macrofagi presenti polmonari rappresentano la popolazione maggiormente studiata dal punto di vista sperimentale. Queste cellule rappresentano la componente cellulare predominante del sistema immunitario a livello dell’apparato respiratorio di MPS. Tuttavia, i macrofagi costituiscono una popolazione eterogenea distribuita all’interno di due compartimenti: i macrofagi alveolari e macrofagi interstiziali. I primi sono maggiormente rappresentati nelle vie aeree (bronchi ed alveoli) i secondi predominano nel tessuto parenchimale.
Differenze morfologiche, fenotipiche e funzionali tra queste due sottpopolazioni sono state osservate nei roditori e nell’uomo. Non esistono tuttavia, ancora evidenze sperimentali in favore di tale eterogeneicità fenotipica e funzionale nei macrofagi polmonari umani. I macrofagi polmonari producono un ampio spettro di mediatori tra cui enzimi, mediatori lipidici, radicali liberi dell’ossigeno, citochine e chemiochine. I macrofagi possono essere attivati da una varietà di stimoli che agiscono su specifici recettori di membrana inclusi i recettori dell’istamina. L’attivazione dei recettori dell’istamina modula diverse funzioni dei macrofagi come l’espressione delle molecole di adesione e l’esocitosi. I macrofagi si trovano spesso in stretta vicinanza con i mastociti nelle vie respiratorie dei pazienti asmatici. L’associazione anatomica tra questi due tipi di cellule suggerisce che i macrofagi polmonari possano essere esposti all’istamina rilasciata localmente da mastociti attivati immunologicamente e possano contribuite al mantenimento e all’evoluzione a lungo termine della flogosi allergica. Numerose evidenze dimostrano che l’interazione dell’istamina con i recettori H1 e H2 elicita risposte che sono spesso divergenti, infatti l’attivazione H1 pare essere prevalentemente stimolatoria mentre la H2 pare essere inibitoria nella maggioranza dei casi. Quindi l’espressione relativa dei recettori H1 e H2 potrebbe essere un meccanismo per spiegare l’eterogeneicità degli effetti dell’istamina sulle cellule infiammatorie ed immunitarie. In questo studio abbiamo caratterizzato due popolazioni di macrofagi nel polmone umano, esse differiscono per densità, dimensioni, caratteristiche fenotipiche, morfologia e risposta funzionale ad LPS.
Il polmone umano contiene almeno due sottotipi di macrofagi tissutali che differiscono in morfologia, morfometria, fenotipo e risposta funzionale ad LPS. La densità di distribuzione di macrofagi polmonari è chiaramente bimodale in gradienti continui ed è mantenuta durante colture in vitro a breve termine. L’eterogeneictà di densità è stata riportata in varie cellule inclusi i monociti, neutrofili, eosinofili, mastociti, e macrofagi. Si ritiene che tali differenze riflettano variazioni nello stato di differenziazione, maturazione o di attivazione. Gli studi di densità sui macrofagi polmonari umani sono stati condotti sia con cellule provenienti dal BAL sia con cellule tissutali ottenute con digestione enzimatica. Sono state utilizzate cellule ottenute per digestione meccanica onde evitare gli effetti possibili del trattamento enzimatico sulle proprietà biochimiche, fenotipiche e funzionali delle cellule. E’ noto che il polmone di mammifero contiene almeno due frazioni macrofagiche alveolare ed interstiziale. Gli studi condotti su cellule umane o murine indicano che alcune caratteristiche dei macrofagi alveolari ed interstiziali possono sovrapporsi a quelle degli LDM ed HDM, rispettivamente. Tuttavia, numerose osservazioni in questo studio supportano l’ipotesi che LDM e HDM non corrispondano strettamente a macrofagi alveolari ed interstiziali. I nostri dati sulla distribuzione relativa degli HDM e LDM suggeriscono, comunque, che gli LDM siano preferenzialmente localizzati negli spazi alveolari mentre gli HDM sono maggiormente posizionati nell’interstizio. Le due popolazioni (LDM e HDM) esprimono alti livelli dei maggiori marker macrofagici quali CD11, CD44, CD71 e HLA-DR e il recettore per il mannosio. L’espressione di CD14 su meno del 5% delle cellule indica che le due popolazioni contengono macrofagi differenziati con una trascurabile contaminazione di monociti. E’ interessante sottolineare che gli LDM e gli HDM differiscono nell’espressione di molecole di superficie coinvolte in funzioni macrofagiche rilevanti. Una piu’ alta percentuale di LDM esprime l’FcγRI (CD64) e CD63, due marker di attivazione cellulare. Al contrario, un maggiore numero di macrofagi nella popolazione HDM esprime CD40 e CD86, molecole che sono principalmente coinvolte nell’interazione con le cellule T. Studi effettuati sulle popolazioni macrofagiche polmonari nell’uomo e di animali da esperimento hanno condotto all’ipotesi che macrofagi ipodensi, maggiormente localizzati negli spazi alveolari siano cellule in uno stato preattivato e prevalentemente coinvolte nella fagocitosi e nell’infiammazione. Al contrario, macrofagi piu’ densi sono considerati cellule meno mature, localizzati nell’interstizio e coinvolte principalmente nella regolazione delle cellule T, nella presentazione dell’antigene e nel rimodellamento tissutale La nostra osservazione che gli LDM esprimono maggiormente marker di attivazione (CD64 e CD63) mentre gli HDM esprimono maggiormente molecole costimolatorie CD40 e CD86 è in linea con questa ipotesi. Questa osservazioni sono anche confermate dai dati ultrastrutturali che mostrano un’abbondanza di lisosomi primari negli HDM e secondari negli LDM. Uno degli obiettivi di questo studio è stato quello di esplorare la responsività dei due subset di macrofagi alla stimolazione con LPS a cui queste cellule potrebbero essere esposte in vivo. L’LPS, il principale costituente della membrana esterna del Gram negativi, induce la sintesi e la secrezione di citochine da macrofagi e monociti, responsabili delle manifestazioni cliniche dello shock settico e di vari disordini infiammatori cronici. In conseguenza del legame a CD14 sulle membrane cellulari di cellule monolitiche, l’LPS è presentato al TLR4, il componente di segnale del complesso recettoriale in presenza delle proteine extracellulari MD-2. Sebbene gli eventi molecolari che comportano il riconoscimento di LPS non sono stati del tutto determinati, la maggior parte delle evidenze suggerisce che LPS si lega al complesso TLR4/MD2/CD14. I nostri dati di citofluorimetria indicano che entrambe le popolazioni di macrofagi esprimono bassi livelli di CD14, il che è in accordo con gli studi precedenti sui macrofagi alveolari umani. Tuttavia entrambe le popolazioni HDM e LDM sintetizzano varie citochine quando vengono attivate da LPS di E. Coli.
Questa interessante osservazione puo’ essere spiegata in diversi modi:
1) CD14 ed altri recettori non ancora conosciuti possono favorire l’attivazione di TLR4 LPS-indotta. Esistono evidenze che i macrofagi isolati da topi knock-out per CD14 possono essere attivati da batteri Gram negativi attraverso l’attivazione di CD11/CD18 e TLR4. In aggiunta topi con deficit di CD14 mostrano ancora una risposta significativa ad LPS . Questi dati indicano che altre molecole possono compensare la mancanza di CD14 e favorire l’attivazione indotta da LPS.
2) Non è possibile escludere la possibilità che la bassa espressione di CD14 possa essere sufficiente a formare un complesso attivo TLR4/MD2/CD14.
3) Una diretta interazione di LPS con il complesso TLR4/MD2 in assenza di CD14 è stata recentemente riportata ed è ipotizzabile che questa interazione potrebbe anche avvenire sui macrofagi polmonari umani. Sebbene attivati in maniera differente i macrofagi producono diversi profili di citochine.
Una originale osservazione è che gli LDM e gli HDM producono differenti quantità di citochine in seguito all’attivazione con lo stesso stimolo. Infatti, gli HDM stimolati con LPS producono livelli significativamente piu’ alti di citochine proinfiammatorie (TNFα e IL-6) rispetto agi LDM. Queste differenza è piu’ spiccata nel caso di IL-10 e IL-12. Quest’ultima osservazione indica che differenze nell’intensità 33 piuttosto che nella qualità delle risposte all’LPS è una delle caratteristiche principali dell’eterogeneicità dei macrofagi polmonari. Nel caso di questo studio sono stati esplorati vari meccanismi che potrebbero spiegare la differente produzione di citochine da parte di HDM e LDM in risposta a LPS. La sintesi di citochine ridotta o abolita nei macrofagi attivati da LPS è stata riportata in cellule mancanti del gene per TLR4. Inoltre, MD-2 e la molecola MyD88 sono cruciali per una risposta efficiente ad LPS. I nostri dati mostrano che non c’è differenza nell’espressione delle isoforme di TLR4 MD-2 e MyD88 tra HDM e LDM. Appare pertanto evidente che i cambiamenti nelle trascrizioni di queste molecole non possono essere responsabili per le differenti risposte ad LPS. L’iporesponsività di LDM all’ LPS di E. Coli potrebbe tuttavia essere mediata dall’espressione difettiva di uno dei diversi trasduttori chiamati in gioco dopo l’arruolamento di TLR4 da parte di LPS. Il segnale attivato a valle nei macrofagi stimolati da LPS include il pathway MAP chinasi ERK1/2 p38 JNK. Questi pathway attivano vari fattori nucleari coinvolti nel controllo dell’espressione del gene delle citochine. L’attivazione della chinasi p38 ed ERK1/2 è necessaria per la produzione di citochine dai macrofagi alveolari umani . LPS è in grado di attivare ERK1/2 e p38 sia negli HDM che negli LDM. Le cinetiche di attivazione sono tuttavia differenti nelle due popolazioni, in quanto la fosforilazione di entrambe le chinasi è significativamente ritardata negli LDM. Le variazioni cronologiche di attivazione delle MAP chinasi sono state associate con differenze nelle mobilizzazioni dei fattori di trascrizione per le citochine nei macrofagi. Le cinetiche dell’attivazione delle MAP chinasi in risposta ad uno stimolo dipende dallo stato di maturazione delle varie linee cellulari e monociti/macrofagi. Queste osservazioni suggeriscono che l’attivazione delle chinasi ERK1/2 e p38 possa essere modulata a seconda dello stimolo usato e dello stato di maturazione cellulare. Anche se i nostri dati non provano in maniera conclusiva che il ritardo dell’attivazione di MAP chinasi sia responsabile della ridotta produzione di citochine da parte di LDM l’alterazione in queste vie di segnale potrebbe spiegare l’iporesponsività di LDM a LPS. Sebbene l’LPS rivela solo differenze quantitative è possibile che altri stimoli possano rivelare differenze qualitative di risposta tra HDM e LDM. Questa ipotesi è in accordo con alcuni dati pubblicati precedentemente dal nostro gruppo che mostravano che l’istamina induce distinti profili di risposta al calcio nei macrofagi polmonari umani.
Questi differenti profili di risposta al calcio potrebbero riflettere sia l’attivazione di diverse popolazioni macrofagiche o differenze qualitative nell’espressione del recettore H1 per l’istamina sui macrofagi. Questo assume una notevole rilevanza alla luce della presente dimostrazione di due distinte sottopopolazioni di macrofagi polmonari. Ulteriori studi saranno necessari per valutare l’espressione di selettivi recettori per l’istamina nelle due sottopopolazioni di macrofagi polmonari. L’evidenza che gli HDM e gli LDM differiscono nei parametri di morfologia/morfometria, fenotipo e risposta ad LPS è fortemente a favore di una reale distinzione tra queste due popolazioni cellulari e dell’esistenza in vivo di differenti subsets di macrofagi con differenti caratteristiche funzionali.
Ulteriori studi sono necessari per stabilire se gli HDM possono diventare LDM in vivo o in vitro. La possibilità che i macrofagi polmonari possano evolvere da un tipo quiescente (HDM) a una variante attivata (LDM) è particolarmente attraente. Questa maturazione potrebbe generare una popolazione di cellule con fenotipi e funzioni diverse. Le implicazioni cliniche dell’eterogeneicità dei macrofagi polmonari non sono conosciute ma i nostri dati suggeriscono che due popolazioni di macrofagi possano partecipare a diverse fasi del processo infiammatorio e delle risposte immuni nel polmone umano.
ENGLISH
Macrophages are the major components of the mononuclear phagocyte system, (Mononucear Phagocyte System MPS), and have an ubiquitous distribution in various organs and tissues. In addition to tissue macrophages, the MPS system includes blood monocytes, dendritic cells, osteoclasts, microglia cells in the central nervous system, Kupffer cells in the liver and Langherans cells in the skin. The cells of the MPS system constitute the first line of defense in bacterial and viral infections and play a primary role in natural immunity. These cells are also able to regulate the immune response and play a primary role in the induction and maintenance of the inflammatory process.
They originate in the bone marrow, probably from a common myeloid precursor CD34 + which gives rise to blood monocytes. Subsequently, monocytes migrate to different tissues where they differentiate into specialized cells following exposure to various microenvironmental factors. Macrophages are present in virtually all organs where they play an important role in local immune and inflammatory responses, in tissue damage and repair, in the clearance of apoptotic cells and in antineoplastic surveillance. Although the macrophages resident in the various tissues have morphological and functional homologies, numerous evidences suggest that there is a profound heterogeneity within this cell population. Macrophages are an ubiquitous cell population in humans and are responsible for multiple and fundamental homeostatic, immunological and inflammatory processes.
The distribution of these cells in different organs and tissues determines their central role in the response to external agents (e.g. infectious), in autoimmune diseases and in the control of neoplastic growth. Dendritic cells, skin Langerhans cells, liver Kupffer cells and central nervous system (CNS) microglia cells share different morphological, biochemical and functional characteristics with tissue macrophages.
The specific functional characteristics of these cells are:
1) the ability to engulf microorganisms (key role in innate immunity)
2) the ability to process antigens and present them to T lymphocytes (key role in acquired immunity)
3) the synthesis of numerous cytokines and chemokines capable of initiating and / or amplifying or ending the inflammatory reaction, promoting the recruitment of inflammatory cells and modulating the lymphocyte response
4) the ability to recognize and destroy cancer cells. Numerous experimental evidences indicate that tissue macrophages and other specialized cellular elements derive from circulating monocytes
Monocytes mature in the bone marrow and reach, through the bloodstream, the different organs where, through exposure to specific local factors, they differ in the different cell types. It should be remembered that a series of experimental observations suggests the possibility that cells of the macrophage line may also develop from stem cells present in peripheral tissues. The hypothesis of the heterogeneity of monocytes and macrophages was initially suspected on the basis of microscopic observations that had allowed to highlight the morphological variety of these cell types. However, only the use of efficient systems for the isolation of these cells from peripheral tissues and the development of adequate methods for the study of their functions have allowed us to identify some functional specificities of these cells. Multiple studies conducted in recent years in the experimental animal have highlighted significant functional differences between macrophages isolated from different organs. For example, the alveolar macrophages of the lung synthesize greater quantities of cytokines and have a more effective tumoricidal action than the macrophages of the peritoneal cavity. In contrast, peritoneal macrophages have a greater capacity for phagocytosis, activation of the respiratory burst and production of nitric oxide than pulmonary ones.
Macrophages isolated from the spleen and thymus express particularly markers implicated in the presentation of the antigen and in the costimulation of T lymphocytes (HLA class II, CD 80 and CD86. These observations suggest that local factors and the tissue microenvironment (eg factors of growth, cytokines, exogenous stimuli) can guide the development and functional maturation of macrophages towards the activity mainly required in a given organ (eg defense against infectious agents, initiation or maintenance of immune responses, tumor surveillance). that most of the observations on the heterogeneity of macrophages derive from studies conducted in the experimental animal. These data, in many cases, cannot be extrapolated to human macrophages. In fact, there are substantial differences in the profile of proinflammatory mediators, in the expression of receptors of membrane and in the mechanisms of activation of human and that macrophages i of the experimental animals studied so far (rat and guinea pig).
Several observations made in recent years indicate a further level of heterogeneity of macrophages isolated from the same organ. For example, at the lung level, functional specificities have been described for macrophages resident in the interstitium (parenchymal macrophages) and at the alveolar level. The former possess phenotypic (membrane receptors) and biochemical (cytokine production) characteristics mainly oriented towards interaction with T lymphocytes and towards anti-tumor surveillance. The latter have characteristics 8 oriented mainly towards the inflammatory response and towards tissue damage and repair. The human lung also contains a highly differentiated cell population consisting of dendritic cells. These cells are particularly specialized cells in the processing and presentation of antigens to T lymphocytes. The dendritic cells are believed to derive from the same precursors of the tissue macrophages (circulating monocytes), they differentiate in the peripheral organs and, once encountered the antigen, migrate to the lymph nodes loco-regional to initiate specific immune response through interaction with T lymphocytes
The pulmonary macrophages represent the population most studied from an experimental point of view. These cells represent the predominant cellular component of the immune system in the respiratory system of MPS. However, macrophages constitute a heterogeneous population distributed within two compartments: alveolar macrophages and interstitial macrophages. The former are mostly represented in the airways (bronchi and alveoli) the latter predominate in the parenchymal tissue.
Morphological, phenotypic and functional differences between these two subpopulations have been observed in rodents and humans. However, there is still no experimental evidence in favor of this phenotypic and functional heterogeneity in human pulmonary macrophages. Lung macrophages produce a broad spectrum of mediators including enzymes, lipid mediators, oxygen free radicals, cytokines and chemokines. Macrophages can be activated by a variety of stimuli that act on specific membrane receptors including histamine receptors. Activation of histamine receptors modulates various functions of macrophages such as the expression of adhesion molecules and exocytosis. Macrophages are often found in close proximity to mast cells in the respiratory tract of asthma patients. The anatomical association between these two types of cells suggests that pulmonary macrophages may be exposed to histamine released locally by immunologically activated mast cells and may contribute to the maintenance and long-term evolution of allergic inflammation. Numerous evidences show that the interaction of histamine with the H1 and H2 receptors elicits responses that are often divergent, in fact the H1 activation seems to be mainly stimulatory while the H2 seems to be inhibitory in the majority of cases. So the relative expression of the H1 and H2 receptors could be a mechanism to explain the heterogeneity of the effects of histamine on inflammatory and immune cells. In this study we characterized two populations of macrophages in the human lung, they differ in density, size, phenotypic characteristics, morphology and functional response to LPS.
The human lung contains at least two subtypes of tissue macrophages that differ in morphology, morphometry, phenotype and functional response to LPS. The distribution density of pulmonary macrophages is clearly bimodal in continuous gradients and is maintained during short-term in vitro cultures. Density heterogeneity has been reported in various cells including monocytes, neutrophils, eosinophils, mast cells, and macrophages. These differences are believed to reflect changes in the differentiation, maturation or activation status. Density studies on human lung macrophages have been carried out both with cells from BAL and with tissue cells obtained with enzymatic digestion. Cells obtained by mechanical digestion have been used to avoid the possible effects of enzymatic treatment on the biochemical, phenotypic and functional properties of the cells. It is known that the mammalian lung contains at least two alveolar and interstitial macrophage fractions. Studies conducted on human or murine cells indicate that some features of alveolar and interstitial macrophages may overlap with those of LDM and HDM, respectively. However, numerous observations in this study support the hypothesis that LDM and HDM do not correspond closely to alveolar and interstitial macrophages. Our data on the relative distribution of HDM and LDM suggest, however, that LDM are preferentially located in the alveolar spaces while HDM are more positioned in the interstitium. The two populations (LDM and HDM) express high levels of the major macrophage markers such as CD11, CD44, CD71 and HLA-DR and the mannose receptor. The expression of CD14 on less than 5% of the cells indicates that the two populations contain differentiated macrophages with negligible monocyte contamination. It is interesting to underline that LDM and HDM differ in the expression of surface molecules involved in relevant macrophage functions. A higher percentage of LDM expresses the FCγRI (CD64) and CD63, two markers of cellular activation. On the contrary, a greater number of macrophages in the HDM population express CD40 and CD86, molecules that are mainly involved in the interaction with T cells. Studies carried out on pulmonary macrophage populations in humans and experimental animals have led to the hypothesis that macrophages hypodense, most localized in the alveolar spaces are cells in a pre-activated state and mainly involved in phagocytosis and inflammation. On the contrary, denser macrophages are considered less mature cells, located in the interstitium and mainly involved in the regulation of T cells, in the presentation of antigen and in tissue remodeling Our observation that LDMs express more activation markers (CD64 and CD63 ) while HDMs express more costimulatory molecules CD40 and CD86 is in line with this hypothesis. These observations are also confirmed by ultrastructural data that show an abundance of primary lysosomes in HDM and secondary in LDM. One of the objectives of this study was to explore the responsiveness of the two subsets of macrophages to stimulation with LPS to which these cells could be exposed in vivo. LPS, the main constituent of the Gram negative outer membrane, induces the synthesis and secretion of cytokines from macrophages and monocytes, responsible for the clinical manifestations of septic shock and various chronic inflammatory disorders. As a consequence of the binding to CD14 on the cell membranes of monolithic cells, the LPS is presented to TLR4, the signal component of the receptor complex in the presence of the extracellular proteins MD-2. Although the molecular events involving LPS recognition have not been fully determined, most evidence suggests that LPS binds to the TLR4 / MD2 / CD14 complex. Our cytofluorimetry data indicate that both macrophage populations express low CD14 levels, which is in agreement with previous studies on human alveolar macrophages. However both HDM and LDM populations synthesize various cytokines when activated by E. Coli LPS.
This interesting observation can be explained in several ways:
1) CD14 and other unknown receptors may favor LPS-induced TLR4 activation. There is evidence that macrophages isolated from CD14 knock-out mice can be activated by Gram negative bacteria through the activation of CD11 / CD18 and TLR4. In addition, CD14 deficient mice still show a significant response to LPS. These data indicate that other molecules can compensate for the lack of CD14 and favor LPS-induced activation.
2) The possibility that the low expression of CD14 may be sufficient to form an active complex TLR4 / MD2 / CD14 cannot be excluded.
3) A direct interaction of LPS with the TLR4 / MD2 complex in the absence of CD14 has recently been reported and it is conceivable that this interaction could also occur on human pulmonary macrophages. Although activated differently, macrophages produce different cytokine profiles.
An original observation is that LDM and HDM produce different quantities of cytokines following activation with the same stimulus. In fact, HDMs stimulated with LPS produce significantly higher levels of proinflammatory cytokines (TNFα and IL-6) than LDM. This difference is more marked in the case of IL-10 and IL-12. This last observation indicates that differences in intensity 33 rather than in the quality of responses to LPS is one of the main characteristics of the heterogeneity of the pulmonary macrophages. In the case of this study, various mechanisms have been explored that could explain the different production of cytokines by HDM and LDM in response to LPS. Reduced or abolished cytokine synthesis in LPS-activated macrophages has been reported in cells missing from the gene for TLR4. In addition, MD-2 and the MyD88 molecule are crucial for an efficient response to LPS. Our data show that there is no difference in the expression of the TLR4 MD-2 and MyD88 isoforms between HDM and LDM. It therefore appears evident that the changes in the transcripts of these molecules cannot be responsible for the different responses to LPS. However, LDM's hyporesponsiveness to E. Coli's LPS could be mediated by the defective expression of one of the different transducers called into play after LPS enrolled TLR4. The signal activated downstream in macrophages stimulated by LPS includes the MAP kinase pathway ERK1 / 2 p38 JNK. These pathways activate various nuclear factors involved in the control of cytokine gene expression. Activation of kinase p38 and ERK1 / 2 is necessary for the production of cytokines from human alveolar macrophages. LPS is able to activate ERK1 / 2 and p38 in both HDM and LDM. However, the activation kinetics are different in the two populations, as the phosphorylation of both kinases is significantly delayed in LDM. Chronological changes in MAP kinase activation have been associated with differences in the mobilization of transcription factors for cytokines in macrophages. The kinetics of the activation of MAP kinases in response to a stimulus depends on the state of maturation of the various cell lines and monocytes / macrophages. These observations suggest that the activation of ERK1 / 2 and p38 kinases may be modulated according to the stimulus used and the cell maturation state. Even if our data do not conclusively prove that the delay in the activation of MAP kinase is responsible for the reduced production of cytokines by LDM, the alteration in these signal pathways could explain the hyporesponsiveness of LDM to LPS. Although LPS reveals only quantitative differences, it is possible that other stimuli may reveal qualitative response differences between HDM and LDM. This hypothesis is in agreement with some data previously published by our group which showed that histamine induces distinct calcium response profiles in human pulmonary macrophages.
These different calcium response profiles could reflect either the activation of different macrophage populations or qualitative differences in the expression of the H1 receptor for histamine on macrophages. This assumes considerable relevance in the light of the present demonstration of two distinct subpopulations of pulmonary macrophages. Further studies will be needed to evaluate the expression of selective histamine receptors in the two subpopulations of pulmonary macrophages. The evidence that HDMs and LDMs differ in morphology / morphometry, phenotype and LPS response parameters strongly supports a real distinction between these two cell populations and the existence in vivo of different subsets of macrophages with different functional characteristics.
Further studies are needed to establish whether HDMs can become LDM in vivo or in vitro. The possibility that pulmonary macrophages may evolve from a quiescent type (HDM) to an activated variant (LDM) is particularly attractive. This maturation could generate a population of cells with different phenotypes and functions. The clinical implications of the heterogeneity of pulmonary macrophages are unknown but our data suggest that two populations of macrophages may participate in different stages of the inflammatory process and immune responses in the human lung.
Da:
http://www.fedoa.unina.it/2762/1/Forte_Fisiopatologia_Clinica_e_Medicina_Sperimentale.pdf
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa

I macrofagi costituiscono i componenti maggiori del sistema dei fagociti mononucleati, (Mononucear Phagocyte System MPS), ed hanno una distribuzione ubiquitaria in diversi organi e tessuti. Oltre ai macrofagi tissutali, il sistema MPS include i monociti del sangue, le cellule dendritiche, gli osteoclasti, le cellule della microglia nel sistema nervoso centrale, le cellule di Kupffer nel fegato e le cellule di Langherans nella cute. Le cellule del sistema MPS costituiscono la prima linea di difesa nelle infezioni batteriche e virali e svolgono un ruolo primario nell’immunità naturale. Queste cellule sono, inoltre, in grado di regolare la risposta immune e svolgono un ruolo primario nel’induzione e nel mantenimento del processo infiammatorio.
Esse originano nel midollo osseo, probabilmente da un precursore mieloide comune CD34+ che da origine ai monociti del sangue. Successivamente, i monociti migrano in diversi tessuti dove si differenziano in cellule specializzate in seguito ad un’esposizione a diversi fattori microambientali. I macrofagi sono presenti virtualmente in tutti gli organi dove giocano un ruolo importante nelle risposte immuni ed infiammatorie locali, nel danno e nella riparazione tissutale, nella clearance delle cellule apoptotiche e nella sorveglianza antineoplastica. Anche se i macrofagi residenti nei vari tessuti presentano omologie morfologiche e funzionali, numerose evidenze suggeriscono che esiste una profonda eterogeneicità all’interno di questa popolazione cellulare. I macrofagi sono una popolazione cellulare ubiquitaria nell’uomo e sono responsabili di molteplici e fondamentali processi omeostatici, immunologici ed infiammatori .
La distribuzione in diversi organi e tessuti di tali cellule ne determina il ruolo centrale nella risposta ad agenti esterni (ad es. di tipo infettivo), nelle malattie autoimmuni e nel controllo della crescita neoplastica. Le cellule dendritiche, le cellule di Langerhans della cute, le cellule di Kupffer del fegato e le cellule della microglia nel sistema nervoso centrale (SNC) condividono con i macrofagi tessutali diverse caratteristiche morfologiche, biochimiche e funzionali.
Le specifiche caratteristiche funzionali di tali cellule sono:
1) la capacità di fagocitare microrganismi (ruolo chiave nell’immunità innata)
2) la capacità di processare antigeni e di presentarli ai linfociti T (ruolo chiave nell’immunità acquisita)
3) la sintesi di numerose citochine e chemochine in grado di iniziare e/o di amplificare o terminare la reazione infiammatoria, di promuovere il reclutamento di cellule infiammatorie e di modulare la risposta linfocitaria
4) la capacità di riconoscere e distruggere cellule neoplastiche. Numerose evidenze sperimentali indicano che i macrofagi tessutali e gli altri elementi cellulari specializzati derivino dai monociti circolanti
I monociti maturano nel midollo osseo e raggiungono, attraverso il circolo ematico, i diversi organi dove, attraverso l’esposizione a specifici fattori locali, si differenziano nei diversi tipi cellulari. È opportuno ricordare che una serie di osservazioni sperimentali suggerisce la possibilità che cellule della linea macrofagica possano svilupparsi anche da cellule staminali presenti in tessuti periferici. L’ipotesi della eterogeneità dei monociti e dei macrofagi è stata inizialmente peospettata sulla base di osservazioni al microscopio che avevano consentito di evidenziare la varietà morfologica di questi tipi cellulari. Tuttavia soltanto l’impiego di sistemi efficienti per l’isolamento di tali cellule dai tessuti periferici e lo sviluppo di metodiche adeguate per lo studio delle loro funzioni hanno permesso di identificare alcune specificità funzionali di queste cellule. Molteplici studi condotti negli ultimi anni nell’animale da esperimento hanno evidenziato significative differenze funzionali tra i macrofagi isolati da organi diversi. Ad esempio, i macrofagi alveolari del polmone sintetizzano maggiori quantità di citochine ed hanno una azione tumoricida più efficace rispetto ai macrofagi della cavità peritoneale. Al contrario, i macrofagi peritoneali hanno una maggiore capacità di fagocitosi, di attivazione del burst respiratorio e di produzione di ossido nitrico rispetto a quelli polmonari.
I macrofagi isolati dalla milza e dal timo esprimono particolarmente marcatori implicati nella presentazione dell’antigene e nella costimolazione dei linfociti T (HLA di classe II, CD 80 e CD86. Queste osservazioni suggeriscono che fattori locali ed il microambiente tessutale (ad es. fattori di crescita, citochine, stimoli esogeni) possano orientare lo sviluppo e la maturazione funzionale dei macrofagi verso l’attività prevalentemente richiesta in un determinato organo (ad es. difesa contro agenti infettivi, inizio o mantenimento di risposte immuni, sorveglianza tumorale). È opportuno sottolineare che la maggior parte delle osservazioni sulla eterogeneità dei macrofagi deriva da studi condotti nell’animale da esperimento. Questi dati, in molti casi, non sono estrapolabili ai macrofagi umani. Infatti, esistono sostanziali differenze nel profilo di mediatori proinfiammatori, nella espressione di recettori di membrana e nei meccanismi di attivazione dei macrofagi umani e di quelli degli animali da esperimento finora studiati (ratto e cavia).
Diverse osservazioni eseguite negli ultimi anni indicano un ulteriore livello di eterogeneità dei macrofagi isolati da uno stesso organo. Ad esempio, a livello polmonare, sono state descritte specificità funzionali per i macrofagi residenti nell’interstizio (macrofagi parenchimali) ed a livello alveolare. I primi possiedono caratteristiche fenotipiche (recettori di membrana) e biochimiche (produzione di citochine) orientate soprattutto verso l’interazione con i linfociti T e verso la sorveglianza anti-tumorale. I secondi presentano caratteristiche 8 orientate prevalentemente verso la risposta infiammatoria e verso il danno e la riparazione tessutale. Il polmone umano contiene inoltre una popolazione cellulare altamente differenziata costituita dalle cellule dendritiche . Queste cellule sono cellule particolarmente specializzate nella processazione e presentazione di antigeni ai linfociti T. Le cellule dendritiche si ritiene derivino dagli stessi precursori dei macrofagi tissutali (monociti circolanti), si differenziano negli organi periferici e, una volta incontrato l'antigene, migrano nei linfonodi loco-regionali per iniziare la risposta immune specifica attraverso l’interazione con linfociti T.
I macrofagi presenti polmonari rappresentano la popolazione maggiormente studiata dal punto di vista sperimentale. Queste cellule rappresentano la componente cellulare predominante del sistema immunitario a livello dell’apparato respiratorio di MPS. Tuttavia, i macrofagi costituiscono una popolazione eterogenea distribuita all’interno di due compartimenti: i macrofagi alveolari e macrofagi interstiziali. I primi sono maggiormente rappresentati nelle vie aeree (bronchi ed alveoli) i secondi predominano nel tessuto parenchimale.
Differenze morfologiche, fenotipiche e funzionali tra queste due sottpopolazioni sono state osservate nei roditori e nell’uomo. Non esistono tuttavia, ancora evidenze sperimentali in favore di tale eterogeneicità fenotipica e funzionale nei macrofagi polmonari umani. I macrofagi polmonari producono un ampio spettro di mediatori tra cui enzimi, mediatori lipidici, radicali liberi dell’ossigeno, citochine e chemiochine. I macrofagi possono essere attivati da una varietà di stimoli che agiscono su specifici recettori di membrana inclusi i recettori dell’istamina. L’attivazione dei recettori dell’istamina modula diverse funzioni dei macrofagi come l’espressione delle molecole di adesione e l’esocitosi. I macrofagi si trovano spesso in stretta vicinanza con i mastociti nelle vie respiratorie dei pazienti asmatici. L’associazione anatomica tra questi due tipi di cellule suggerisce che i macrofagi polmonari possano essere esposti all’istamina rilasciata localmente da mastociti attivati immunologicamente e possano contribuite al mantenimento e all’evoluzione a lungo termine della flogosi allergica. Numerose evidenze dimostrano che l’interazione dell’istamina con i recettori H1 e H2 elicita risposte che sono spesso divergenti, infatti l’attivazione H1 pare essere prevalentemente stimolatoria mentre la H2 pare essere inibitoria nella maggioranza dei casi. Quindi l’espressione relativa dei recettori H1 e H2 potrebbe essere un meccanismo per spiegare l’eterogeneicità degli effetti dell’istamina sulle cellule infiammatorie ed immunitarie. In questo studio abbiamo caratterizzato due popolazioni di macrofagi nel polmone umano, esse differiscono per densità, dimensioni, caratteristiche fenotipiche, morfologia e risposta funzionale ad LPS.
Il polmone umano contiene almeno due sottotipi di macrofagi tissutali che differiscono in morfologia, morfometria, fenotipo e risposta funzionale ad LPS. La densità di distribuzione di macrofagi polmonari è chiaramente bimodale in gradienti continui ed è mantenuta durante colture in vitro a breve termine. L’eterogeneictà di densità è stata riportata in varie cellule inclusi i monociti, neutrofili, eosinofili, mastociti, e macrofagi. Si ritiene che tali differenze riflettano variazioni nello stato di differenziazione, maturazione o di attivazione. Gli studi di densità sui macrofagi polmonari umani sono stati condotti sia con cellule provenienti dal BAL sia con cellule tissutali ottenute con digestione enzimatica. Sono state utilizzate cellule ottenute per digestione meccanica onde evitare gli effetti possibili del trattamento enzimatico sulle proprietà biochimiche, fenotipiche e funzionali delle cellule. E’ noto che il polmone di mammifero contiene almeno due frazioni macrofagiche alveolare ed interstiziale. Gli studi condotti su cellule umane o murine indicano che alcune caratteristiche dei macrofagi alveolari ed interstiziali possono sovrapporsi a quelle degli LDM ed HDM, rispettivamente. Tuttavia, numerose osservazioni in questo studio supportano l’ipotesi che LDM e HDM non corrispondano strettamente a macrofagi alveolari ed interstiziali. I nostri dati sulla distribuzione relativa degli HDM e LDM suggeriscono, comunque, che gli LDM siano preferenzialmente localizzati negli spazi alveolari mentre gli HDM sono maggiormente posizionati nell’interstizio. Le due popolazioni (LDM e HDM) esprimono alti livelli dei maggiori marker macrofagici quali CD11, CD44, CD71 e HLA-DR e il recettore per il mannosio. L’espressione di CD14 su meno del 5% delle cellule indica che le due popolazioni contengono macrofagi differenziati con una trascurabile contaminazione di monociti. E’ interessante sottolineare che gli LDM e gli HDM differiscono nell’espressione di molecole di superficie coinvolte in funzioni macrofagiche rilevanti. Una piu’ alta percentuale di LDM esprime l’FcγRI (CD64) e CD63, due marker di attivazione cellulare. Al contrario, un maggiore numero di macrofagi nella popolazione HDM esprime CD40 e CD86, molecole che sono principalmente coinvolte nell’interazione con le cellule T. Studi effettuati sulle popolazioni macrofagiche polmonari nell’uomo e di animali da esperimento hanno condotto all’ipotesi che macrofagi ipodensi, maggiormente localizzati negli spazi alveolari siano cellule in uno stato preattivato e prevalentemente coinvolte nella fagocitosi e nell’infiammazione. Al contrario, macrofagi piu’ densi sono considerati cellule meno mature, localizzati nell’interstizio e coinvolte principalmente nella regolazione delle cellule T, nella presentazione dell’antigene e nel rimodellamento tissutale La nostra osservazione che gli LDM esprimono maggiormente marker di attivazione (CD64 e CD63) mentre gli HDM esprimono maggiormente molecole costimolatorie CD40 e CD86 è in linea con questa ipotesi. Questa osservazioni sono anche confermate dai dati ultrastrutturali che mostrano un’abbondanza di lisosomi primari negli HDM e secondari negli LDM. Uno degli obiettivi di questo studio è stato quello di esplorare la responsività dei due subset di macrofagi alla stimolazione con LPS a cui queste cellule potrebbero essere esposte in vivo. L’LPS, il principale costituente della membrana esterna del Gram negativi, induce la sintesi e la secrezione di citochine da macrofagi e monociti, responsabili delle manifestazioni cliniche dello shock settico e di vari disordini infiammatori cronici. In conseguenza del legame a CD14 sulle membrane cellulari di cellule monolitiche, l’LPS è presentato al TLR4, il componente di segnale del complesso recettoriale in presenza delle proteine extracellulari MD-2. Sebbene gli eventi molecolari che comportano il riconoscimento di LPS non sono stati del tutto determinati, la maggior parte delle evidenze suggerisce che LPS si lega al complesso TLR4/MD2/CD14. I nostri dati di citofluorimetria indicano che entrambe le popolazioni di macrofagi esprimono bassi livelli di CD14, il che è in accordo con gli studi precedenti sui macrofagi alveolari umani. Tuttavia entrambe le popolazioni HDM e LDM sintetizzano varie citochine quando vengono attivate da LPS di E. Coli.
Questa interessante osservazione puo’ essere spiegata in diversi modi:
1) CD14 ed altri recettori non ancora conosciuti possono favorire l’attivazione di TLR4 LPS-indotta. Esistono evidenze che i macrofagi isolati da topi knock-out per CD14 possono essere attivati da batteri Gram negativi attraverso l’attivazione di CD11/CD18 e TLR4. In aggiunta topi con deficit di CD14 mostrano ancora una risposta significativa ad LPS . Questi dati indicano che altre molecole possono compensare la mancanza di CD14 e favorire l’attivazione indotta da LPS.
2) Non è possibile escludere la possibilità che la bassa espressione di CD14 possa essere sufficiente a formare un complesso attivo TLR4/MD2/CD14.
3) Una diretta interazione di LPS con il complesso TLR4/MD2 in assenza di CD14 è stata recentemente riportata ed è ipotizzabile che questa interazione potrebbe anche avvenire sui macrofagi polmonari umani. Sebbene attivati in maniera differente i macrofagi producono diversi profili di citochine.
Una originale osservazione è che gli LDM e gli HDM producono differenti quantità di citochine in seguito all’attivazione con lo stesso stimolo. Infatti, gli HDM stimolati con LPS producono livelli significativamente piu’ alti di citochine proinfiammatorie (TNFα e IL-6) rispetto agi LDM. Queste differenza è piu’ spiccata nel caso di IL-10 e IL-12. Quest’ultima osservazione indica che differenze nell’intensità 33 piuttosto che nella qualità delle risposte all’LPS è una delle caratteristiche principali dell’eterogeneicità dei macrofagi polmonari. Nel caso di questo studio sono stati esplorati vari meccanismi che potrebbero spiegare la differente produzione di citochine da parte di HDM e LDM in risposta a LPS. La sintesi di citochine ridotta o abolita nei macrofagi attivati da LPS è stata riportata in cellule mancanti del gene per TLR4. Inoltre, MD-2 e la molecola MyD88 sono cruciali per una risposta efficiente ad LPS. I nostri dati mostrano che non c’è differenza nell’espressione delle isoforme di TLR4 MD-2 e MyD88 tra HDM e LDM. Appare pertanto evidente che i cambiamenti nelle trascrizioni di queste molecole non possono essere responsabili per le differenti risposte ad LPS. L’iporesponsività di LDM all’ LPS di E. Coli potrebbe tuttavia essere mediata dall’espressione difettiva di uno dei diversi trasduttori chiamati in gioco dopo l’arruolamento di TLR4 da parte di LPS. Il segnale attivato a valle nei macrofagi stimolati da LPS include il pathway MAP chinasi ERK1/2 p38 JNK. Questi pathway attivano vari fattori nucleari coinvolti nel controllo dell’espressione del gene delle citochine. L’attivazione della chinasi p38 ed ERK1/2 è necessaria per la produzione di citochine dai macrofagi alveolari umani . LPS è in grado di attivare ERK1/2 e p38 sia negli HDM che negli LDM. Le cinetiche di attivazione sono tuttavia differenti nelle due popolazioni, in quanto la fosforilazione di entrambe le chinasi è significativamente ritardata negli LDM. Le variazioni cronologiche di attivazione delle MAP chinasi sono state associate con differenze nelle mobilizzazioni dei fattori di trascrizione per le citochine nei macrofagi. Le cinetiche dell’attivazione delle MAP chinasi in risposta ad uno stimolo dipende dallo stato di maturazione delle varie linee cellulari e monociti/macrofagi. Queste osservazioni suggeriscono che l’attivazione delle chinasi ERK1/2 e p38 possa essere modulata a seconda dello stimolo usato e dello stato di maturazione cellulare. Anche se i nostri dati non provano in maniera conclusiva che il ritardo dell’attivazione di MAP chinasi sia responsabile della ridotta produzione di citochine da parte di LDM l’alterazione in queste vie di segnale potrebbe spiegare l’iporesponsività di LDM a LPS. Sebbene l’LPS rivela solo differenze quantitative è possibile che altri stimoli possano rivelare differenze qualitative di risposta tra HDM e LDM. Questa ipotesi è in accordo con alcuni dati pubblicati precedentemente dal nostro gruppo che mostravano che l’istamina induce distinti profili di risposta al calcio nei macrofagi polmonari umani.
Questi differenti profili di risposta al calcio potrebbero riflettere sia l’attivazione di diverse popolazioni macrofagiche o differenze qualitative nell’espressione del recettore H1 per l’istamina sui macrofagi. Questo assume una notevole rilevanza alla luce della presente dimostrazione di due distinte sottopopolazioni di macrofagi polmonari. Ulteriori studi saranno necessari per valutare l’espressione di selettivi recettori per l’istamina nelle due sottopopolazioni di macrofagi polmonari. L’evidenza che gli HDM e gli LDM differiscono nei parametri di morfologia/morfometria, fenotipo e risposta ad LPS è fortemente a favore di una reale distinzione tra queste due popolazioni cellulari e dell’esistenza in vivo di differenti subsets di macrofagi con differenti caratteristiche funzionali.
Ulteriori studi sono necessari per stabilire se gli HDM possono diventare LDM in vivo o in vitro. La possibilità che i macrofagi polmonari possano evolvere da un tipo quiescente (HDM) a una variante attivata (LDM) è particolarmente attraente. Questa maturazione potrebbe generare una popolazione di cellule con fenotipi e funzioni diverse. Le implicazioni cliniche dell’eterogeneicità dei macrofagi polmonari non sono conosciute ma i nostri dati suggeriscono che due popolazioni di macrofagi possano partecipare a diverse fasi del processo infiammatorio e delle risposte immuni nel polmone umano.
ENGLISH
Macrophages are the major components of the mononuclear phagocyte system, (Mononucear Phagocyte System MPS), and have an ubiquitous distribution in various organs and tissues. In addition to tissue macrophages, the MPS system includes blood monocytes, dendritic cells, osteoclasts, microglia cells in the central nervous system, Kupffer cells in the liver and Langherans cells in the skin. The cells of the MPS system constitute the first line of defense in bacterial and viral infections and play a primary role in natural immunity. These cells are also able to regulate the immune response and play a primary role in the induction and maintenance of the inflammatory process.
They originate in the bone marrow, probably from a common myeloid precursor CD34 + which gives rise to blood monocytes. Subsequently, monocytes migrate to different tissues where they differentiate into specialized cells following exposure to various microenvironmental factors. Macrophages are present in virtually all organs where they play an important role in local immune and inflammatory responses, in tissue damage and repair, in the clearance of apoptotic cells and in antineoplastic surveillance. Although the macrophages resident in the various tissues have morphological and functional homologies, numerous evidences suggest that there is a profound heterogeneity within this cell population. Macrophages are an ubiquitous cell population in humans and are responsible for multiple and fundamental homeostatic, immunological and inflammatory processes.
The distribution of these cells in different organs and tissues determines their central role in the response to external agents (e.g. infectious), in autoimmune diseases and in the control of neoplastic growth. Dendritic cells, skin Langerhans cells, liver Kupffer cells and central nervous system (CNS) microglia cells share different morphological, biochemical and functional characteristics with tissue macrophages.
The specific functional characteristics of these cells are:
1) the ability to engulf microorganisms (key role in innate immunity)
2) the ability to process antigens and present them to T lymphocytes (key role in acquired immunity)
3) the synthesis of numerous cytokines and chemokines capable of initiating and / or amplifying or ending the inflammatory reaction, promoting the recruitment of inflammatory cells and modulating the lymphocyte response
4) the ability to recognize and destroy cancer cells. Numerous experimental evidences indicate that tissue macrophages and other specialized cellular elements derive from circulating monocytes
Monocytes mature in the bone marrow and reach, through the bloodstream, the different organs where, through exposure to specific local factors, they differ in the different cell types. It should be remembered that a series of experimental observations suggests the possibility that cells of the macrophage line may also develop from stem cells present in peripheral tissues. The hypothesis of the heterogeneity of monocytes and macrophages was initially suspected on the basis of microscopic observations that had allowed to highlight the morphological variety of these cell types. However, only the use of efficient systems for the isolation of these cells from peripheral tissues and the development of adequate methods for the study of their functions have allowed us to identify some functional specificities of these cells. Multiple studies conducted in recent years in the experimental animal have highlighted significant functional differences between macrophages isolated from different organs. For example, the alveolar macrophages of the lung synthesize greater quantities of cytokines and have a more effective tumoricidal action than the macrophages of the peritoneal cavity. In contrast, peritoneal macrophages have a greater capacity for phagocytosis, activation of the respiratory burst and production of nitric oxide than pulmonary ones.
Macrophages isolated from the spleen and thymus express particularly markers implicated in the presentation of the antigen and in the costimulation of T lymphocytes (HLA class II, CD 80 and CD86. These observations suggest that local factors and the tissue microenvironment (eg factors of growth, cytokines, exogenous stimuli) can guide the development and functional maturation of macrophages towards the activity mainly required in a given organ (eg defense against infectious agents, initiation or maintenance of immune responses, tumor surveillance). that most of the observations on the heterogeneity of macrophages derive from studies conducted in the experimental animal. These data, in many cases, cannot be extrapolated to human macrophages. In fact, there are substantial differences in the profile of proinflammatory mediators, in the expression of receptors of membrane and in the mechanisms of activation of human and that macrophages i of the experimental animals studied so far (rat and guinea pig).
Several observations made in recent years indicate a further level of heterogeneity of macrophages isolated from the same organ. For example, at the lung level, functional specificities have been described for macrophages resident in the interstitium (parenchymal macrophages) and at the alveolar level. The former possess phenotypic (membrane receptors) and biochemical (cytokine production) characteristics mainly oriented towards interaction with T lymphocytes and towards anti-tumor surveillance. The latter have characteristics 8 oriented mainly towards the inflammatory response and towards tissue damage and repair. The human lung also contains a highly differentiated cell population consisting of dendritic cells. These cells are particularly specialized cells in the processing and presentation of antigens to T lymphocytes. The dendritic cells are believed to derive from the same precursors of the tissue macrophages (circulating monocytes), they differentiate in the peripheral organs and, once encountered the antigen, migrate to the lymph nodes loco-regional to initiate specific immune response through interaction with T lymphocytes
The pulmonary macrophages represent the population most studied from an experimental point of view. These cells represent the predominant cellular component of the immune system in the respiratory system of MPS. However, macrophages constitute a heterogeneous population distributed within two compartments: alveolar macrophages and interstitial macrophages. The former are mostly represented in the airways (bronchi and alveoli) the latter predominate in the parenchymal tissue.
Morphological, phenotypic and functional differences between these two subpopulations have been observed in rodents and humans. However, there is still no experimental evidence in favor of this phenotypic and functional heterogeneity in human pulmonary macrophages. Lung macrophages produce a broad spectrum of mediators including enzymes, lipid mediators, oxygen free radicals, cytokines and chemokines. Macrophages can be activated by a variety of stimuli that act on specific membrane receptors including histamine receptors. Activation of histamine receptors modulates various functions of macrophages such as the expression of adhesion molecules and exocytosis. Macrophages are often found in close proximity to mast cells in the respiratory tract of asthma patients. The anatomical association between these two types of cells suggests that pulmonary macrophages may be exposed to histamine released locally by immunologically activated mast cells and may contribute to the maintenance and long-term evolution of allergic inflammation. Numerous evidences show that the interaction of histamine with the H1 and H2 receptors elicits responses that are often divergent, in fact the H1 activation seems to be mainly stimulatory while the H2 seems to be inhibitory in the majority of cases. So the relative expression of the H1 and H2 receptors could be a mechanism to explain the heterogeneity of the effects of histamine on inflammatory and immune cells. In this study we characterized two populations of macrophages in the human lung, they differ in density, size, phenotypic characteristics, morphology and functional response to LPS.
The human lung contains at least two subtypes of tissue macrophages that differ in morphology, morphometry, phenotype and functional response to LPS. The distribution density of pulmonary macrophages is clearly bimodal in continuous gradients and is maintained during short-term in vitro cultures. Density heterogeneity has been reported in various cells including monocytes, neutrophils, eosinophils, mast cells, and macrophages. These differences are believed to reflect changes in the differentiation, maturation or activation status. Density studies on human lung macrophages have been carried out both with cells from BAL and with tissue cells obtained with enzymatic digestion. Cells obtained by mechanical digestion have been used to avoid the possible effects of enzymatic treatment on the biochemical, phenotypic and functional properties of the cells. It is known that the mammalian lung contains at least two alveolar and interstitial macrophage fractions. Studies conducted on human or murine cells indicate that some features of alveolar and interstitial macrophages may overlap with those of LDM and HDM, respectively. However, numerous observations in this study support the hypothesis that LDM and HDM do not correspond closely to alveolar and interstitial macrophages. Our data on the relative distribution of HDM and LDM suggest, however, that LDM are preferentially located in the alveolar spaces while HDM are more positioned in the interstitium. The two populations (LDM and HDM) express high levels of the major macrophage markers such as CD11, CD44, CD71 and HLA-DR and the mannose receptor. The expression of CD14 on less than 5% of the cells indicates that the two populations contain differentiated macrophages with negligible monocyte contamination. It is interesting to underline that LDM and HDM differ in the expression of surface molecules involved in relevant macrophage functions. A higher percentage of LDM expresses the FCγRI (CD64) and CD63, two markers of cellular activation. On the contrary, a greater number of macrophages in the HDM population express CD40 and CD86, molecules that are mainly involved in the interaction with T cells. Studies carried out on pulmonary macrophage populations in humans and experimental animals have led to the hypothesis that macrophages hypodense, most localized in the alveolar spaces are cells in a pre-activated state and mainly involved in phagocytosis and inflammation. On the contrary, denser macrophages are considered less mature cells, located in the interstitium and mainly involved in the regulation of T cells, in the presentation of antigen and in tissue remodeling Our observation that LDMs express more activation markers (CD64 and CD63 ) while HDMs express more costimulatory molecules CD40 and CD86 is in line with this hypothesis. These observations are also confirmed by ultrastructural data that show an abundance of primary lysosomes in HDM and secondary in LDM. One of the objectives of this study was to explore the responsiveness of the two subsets of macrophages to stimulation with LPS to which these cells could be exposed in vivo. LPS, the main constituent of the Gram negative outer membrane, induces the synthesis and secretion of cytokines from macrophages and monocytes, responsible for the clinical manifestations of septic shock and various chronic inflammatory disorders. As a consequence of the binding to CD14 on the cell membranes of monolithic cells, the LPS is presented to TLR4, the signal component of the receptor complex in the presence of the extracellular proteins MD-2. Although the molecular events involving LPS recognition have not been fully determined, most evidence suggests that LPS binds to the TLR4 / MD2 / CD14 complex. Our cytofluorimetry data indicate that both macrophage populations express low CD14 levels, which is in agreement with previous studies on human alveolar macrophages. However both HDM and LDM populations synthesize various cytokines when activated by E. Coli LPS.
This interesting observation can be explained in several ways:
1) CD14 and other unknown receptors may favor LPS-induced TLR4 activation. There is evidence that macrophages isolated from CD14 knock-out mice can be activated by Gram negative bacteria through the activation of CD11 / CD18 and TLR4. In addition, CD14 deficient mice still show a significant response to LPS. These data indicate that other molecules can compensate for the lack of CD14 and favor LPS-induced activation.
2) The possibility that the low expression of CD14 may be sufficient to form an active complex TLR4 / MD2 / CD14 cannot be excluded.
3) A direct interaction of LPS with the TLR4 / MD2 complex in the absence of CD14 has recently been reported and it is conceivable that this interaction could also occur on human pulmonary macrophages. Although activated differently, macrophages produce different cytokine profiles.
An original observation is that LDM and HDM produce different quantities of cytokines following activation with the same stimulus. In fact, HDMs stimulated with LPS produce significantly higher levels of proinflammatory cytokines (TNFα and IL-6) than LDM. This difference is more marked in the case of IL-10 and IL-12. This last observation indicates that differences in intensity 33 rather than in the quality of responses to LPS is one of the main characteristics of the heterogeneity of the pulmonary macrophages. In the case of this study, various mechanisms have been explored that could explain the different production of cytokines by HDM and LDM in response to LPS. Reduced or abolished cytokine synthesis in LPS-activated macrophages has been reported in cells missing from the gene for TLR4. In addition, MD-2 and the MyD88 molecule are crucial for an efficient response to LPS. Our data show that there is no difference in the expression of the TLR4 MD-2 and MyD88 isoforms between HDM and LDM. It therefore appears evident that the changes in the transcripts of these molecules cannot be responsible for the different responses to LPS. However, LDM's hyporesponsiveness to E. Coli's LPS could be mediated by the defective expression of one of the different transducers called into play after LPS enrolled TLR4. The signal activated downstream in macrophages stimulated by LPS includes the MAP kinase pathway ERK1 / 2 p38 JNK. These pathways activate various nuclear factors involved in the control of cytokine gene expression. Activation of kinase p38 and ERK1 / 2 is necessary for the production of cytokines from human alveolar macrophages. LPS is able to activate ERK1 / 2 and p38 in both HDM and LDM. However, the activation kinetics are different in the two populations, as the phosphorylation of both kinases is significantly delayed in LDM. Chronological changes in MAP kinase activation have been associated with differences in the mobilization of transcription factors for cytokines in macrophages. The kinetics of the activation of MAP kinases in response to a stimulus depends on the state of maturation of the various cell lines and monocytes / macrophages. These observations suggest that the activation of ERK1 / 2 and p38 kinases may be modulated according to the stimulus used and the cell maturation state. Even if our data do not conclusively prove that the delay in the activation of MAP kinase is responsible for the reduced production of cytokines by LDM, the alteration in these signal pathways could explain the hyporesponsiveness of LDM to LPS. Although LPS reveals only quantitative differences, it is possible that other stimuli may reveal qualitative response differences between HDM and LDM. This hypothesis is in agreement with some data previously published by our group which showed that histamine induces distinct calcium response profiles in human pulmonary macrophages.
These different calcium response profiles could reflect either the activation of different macrophage populations or qualitative differences in the expression of the H1 receptor for histamine on macrophages. This assumes considerable relevance in the light of the present demonstration of two distinct subpopulations of pulmonary macrophages. Further studies will be needed to evaluate the expression of selective histamine receptors in the two subpopulations of pulmonary macrophages. The evidence that HDMs and LDMs differ in morphology / morphometry, phenotype and LPS response parameters strongly supports a real distinction between these two cell populations and the existence in vivo of different subsets of macrophages with different functional characteristics.
Further studies are needed to establish whether HDMs can become LDM in vivo or in vitro. The possibility that pulmonary macrophages may evolve from a quiescent type (HDM) to an activated variant (LDM) is particularly attractive. This maturation could generate a population of cells with different phenotypes and functions. The clinical implications of the heterogeneity of pulmonary macrophages are unknown but our data suggest that two populations of macrophages may participate in different stages of the inflammatory process and immune responses in the human lung.
Da:
http://www.fedoa.unina.it/2762/1/Forte_Fisiopatologia_Clinica_e_Medicina_Sperimentale.pdf



Commenti
Posta un commento