Evil Astrocytes Emit Neuron-Killing Toxin / Gli astrociti maligni emettono una tossina che uccide i neuroni
Evil Astrocytes Emit Neuron-Killing Toxin / Gli astrociti maligni emettono una tossina che uccide i neuroni
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
The dark turn, which may be instigated by infection or trauma, has been detailed by scientists based at Stanford University Medical Center, who suggest that a broad range of brain disorders may be treatable by blocking astrocytes' metamorphosis into toxic cells, or by pharmaceutically countering the neuron-killing toxin these harmful cells almost certainly secrete.
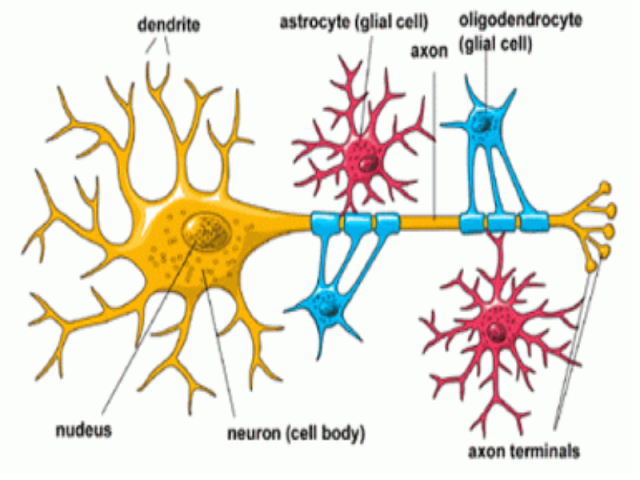
Aberrant astrocytes, “turn up in suspicious abundance in all the wrong places,” says Stanford’s Ben Barres, M.D., Ph.D., a professor of neurobiology, developmental biology, and neurology and neurological sciences. Dr. Barres and colleagues have found that these cells appear in brain-tissue samples from patients with brain injuries and major neurological disorders from Alzheimer's and Parkinson's to multiple sclerosis.
These findings appeared January 18 in the journal Nature, in an article entitled “Neurotoxic Reactive Astrocytes Are Induced by Activated Microglia.” Besides demonstrating that aberrant astrocytes tend to be prevalent where injury is most dire or disease most acute, the article’s authors determined that microglia play a role in transforming benign astrocytes to killer astrocytes. Finally, they obtained results suggesting that aberrant astrocytes secrete a neuron-killing toxin.
“Here we show that a subtype of reactive astrocytes, which we termed A1, is induced by classically activated neuroinflammatory microglia,” wrote the article’s authors. “We show that activated microglia induce A1 astrocytes by secreting Il-1α, TNF and C1q, and that these cytokines together are necessary and sufficient to induce A1 astrocytes.”
In 2012, Barres and his colleagues resolved that ambiguity when they identified two distinct types of reactive astrocytes, which they called A1 and A2. In the presence of lipopolysaccharide (LPS), a component found in the cell walls of bacteria, they observed that resting astrocytes somehow wind up getting transformed into A1s, which are primed to produce large volumes of proinflammatory substances. A2s, on the other hand, are induced by oxygen deprivation in the brain, which occurs during strokes. A2s produce substances supporting neuron growth, health, and survival near the stroke site.
In the current study, Barres and co-workers followed up on these results by showing that the brain's immune cells, microglia, which are known to become activated by LPS exposure as well as in most brain injuries and diseases, begin spewing out proinflammatory factors that change astrocytes' behavior.
Next, the researchers confirmed that A1s jettison the nurturing qualities they'd had as resting astrocytes, which Barres' group has shown are essential to the formation and functioning of synapses, and instead became toxic to neurons.
“A1 astrocytes lose the ability to promote neuronal survival, outgrowth, synaptogenesis and phagocytosis, and induce the death of neurons and oligodendrocytes,” the authors of the Nature paper indicated. “Death of axotomized CNS neurons in vivo is prevented when the formation of A1 astrocytes is blocked.”
In vertebrates, nerve cells called retinal ganglion cells (RGCs) send information from the retina to vision-processing centers in the brain. RGCs can thrive in culture, but only if accompanied by astrocytes. The scientists cultured rodent RGCs with either resting or A1 astrocytes and counted the resulting synapse numbers. RGCs cultured in combination with A1s produced only half as many synapses as RGCs grown with resting astrocytes, and those that formed didn't work very well.
Indeed, when the researchers cultured healthy RGCs with increasingly stronger concentrations of the broth in which A1s had been bathing, almost all the RGCs eventually died. This and other experiments showed that A1s secrete a powerful, neuron-killing toxin.
The same treatment killed many other types of neurons, including both the spinal motor neurons that die in amyotrophic lateral sclerosis and the human dopaminergic neurons whose mysterious loss is the cause of Parkinson's disease. A1 bathwater also impaired the development of yet another class of non-neuron brain cells called oligodendrocytes—essentially fat-filled flapjacks that wrap themselves around nerve fibers, providing electrical insulation that speeds long-distance signal propagation. Autoimmune destruction of oligodendrocytes and their fatty contents gives rise to multiple sclerosis.
In another experiment, the researchers severed rodents' optic nerves—an act ordinarily lethal to RGCs, whose outgoing fibers, called axons, constitute the optic nerve. In the central nervous system, severing axons causes the entire neuron to die quickly, but why they die has been a mystery. The investigators determined the cause: A1s. They observed that those reactive astrocytes formed quickly after axons were severed, but that neutralizing tumor necrosis factor-alpha (TNF-alpha), interleukin-1-alpha (IL-1-alpha), and C1q with antibodies to these three substances prevented A1 formation and RGC death in the animals.
Finally, the researchers analyzed samples of human brain tissue from patients with Alzheimer's disease, Parkinson's disease, Huntington's disease, amyotrophic lateral sclerosis, and multiple sclerosis. In every case, they observed large numbers of A1s preferentially clustering where the disease was most active. For example, in the samples from Alzheimer's patients, nearly 60% of the astrocytes present in the prefrontal cortex, a region where the disease takes a great toll, were of the A1 variety. Because A1s are highly toxic to both neurons and oligodendrocytes, these findings strongly imply that A1 formation is helping to drive neurodegeneration in these diseases.
An effort to identify the neurotoxin secreted by A1 astrocytes is underway, informed Dr. Barres. “We're very excited by the discovery of neurotoxic reactive astrocytes,” he said, “because our findings imply that acute injuries of the retina, brain, and spinal cord and neurodegenerative diseases may all be much more highly treatable than has been thought.”
ITALIANO
Gli astrociti sono di solito i bravi ragazzi. Sebbene siano quattro volte più numerosi nel cervello dei neuroni, svolgono felicemente un ruolo di supporto, servendo come impacchettare le arachidi o facilitando la formazione e la potatura delle connessioni neuronali. Tuttavia, gli astrociti buoni o gli astrociti a riposo possono diventare quelli che sono noti come astrociti reattivi, alcuni dei quali trasformano il male, distruggendo le cellule nervose e probabilmente causano molte malattie neurodegenerative.
La svolta oscura, che può essere scatenata da un'infezione o da un trauma, è stata dettagliata dagli scienziati della Stanford University Medical Center, che suggeriscono che un'ampia gamma di disturbi cerebrali può essere curabile bloccando la metamorfosi degli astrociti in cellule tossiche o contrastando farmaceuticamente la tossina che uccide i neuroni che queste cellule nocive secernono quasi certamente.
Gli astrociti aberranti, "si presentano in abbondanza sospetta in tutti i posti sbagliati", afferma Ben Barres, M.D., Ph.D. di Stanford, professore di neurobiologia, biologia dello sviluppo e neurologia e scienze neurologiche. Il dott. Barres e colleghi hanno scoperto che queste cellule compaiono in campioni di tessuto cerebrale di pazienti con lesioni cerebrali e gravi disturbi neurologici da Alzheimer e Parkinson alla sclerosi multipla.
Questi risultati sono apparsi il 18 gennaio sulla rivista Nature, in un articolo intitolato "Gli astrociti neurotossici reattivi sono indotti dalla microglia attivata". Oltre a dimostrare che gli astrociti aberranti tendono ad essere prevalenti laddove la lesione è più grave o la malattia più acuta, gli autori dell'articolo hanno stabilito che la microglia svolge un ruolo nel trasformare gli astrociti benigni in astrociti assassini. Infine, hanno ottenuto risultati che suggeriscono che gli astrociti aberranti secernono una tossina che uccide i neuroni.
"Qui mostriamo che un sottotipo di astrociti reattivi, che abbiamo chiamato A1, è indotto da microglia neuroinfiammatoria attivata classicamente", hanno scritto gli autori dell'articolo. "Mostriamo che la microglia attivata induce astrociti A1 secernendo Il-1α, TNF e C1q, e che queste citochine insieme sono necessarie e sufficienti per indurre astrociti A1."
Nel 2012, Barres e i suoi colleghi hanno risolto quell'ambiguità quando hanno identificato due distinti tipi di astrociti reattivi, che hanno chiamato A1 e A2. In presenza di lipopolisaccaride (LPS), un componente presente nelle pareti cellulari dei batteri, hanno osservato che gli astrociti a riposo finiscono in qualche modo per trasformarsi in A1, che vengono innescati per produrre grandi volumi di sostanze proinfiammatorie. Le A2, d'altra parte, sono indotte dalla deprivazione di ossigeno nel cervello, che si verifica durante gli ictus. Gli A2 producono sostanze che supportano la crescita, la salute e la sopravvivenza dei neuroni vicino al sito dell'ictus.
Nel presente studio, Barres e collaboratori hanno seguito questi risultati dimostrando che le cellule immunitarie del cervello, la microglia, che sono note per essere attivate dall'esposizione a LPS e nella maggior parte delle lesioni e malattie del cervello, iniziano a generare fattori proinfiammatori che cambia il comportamento degli astrociti.
Successivamente, i ricercatori hanno confermato che gli A1 eliminano le qualità nutritive che avevano avuto come astrociti a riposo, che il gruppo di Barres ha dimostrato che sono essenziali per la formazione e il funzionamento delle sinapsi e che invece sono diventati tossici per i neuroni.
"Gli astrociti A1 perdono la capacità di promuovere la sopravvivenza, l'espansione, la sinaptogenesi e la fagocitosi dei neuroni e inducono la morte di neuroni e oligodendrociti", hanno indicato gli autori dell'articolo di Nature. "La morte dei neuroni del SNC assotomizzati in vivo è prevenuta quando viene bloccata la formazione di astrociti A1."
Nei vertebrati, le cellule nervose chiamate cellule gangliari della retina (RGC) inviano informazioni dalla retina ai centri di elaborazione della visione nel cervello. Le RGC possono prosperare in coltura, ma solo se accompagnate da astrociti. Gli scienziati hanno coltivato RGC di roditori con astrociti a riposo o A1 e hanno contato i numeri di sinapsi risultanti. Gli RGC coltivati in combinazione con gli A1 hanno prodotto solo la metà delle sinapsi degli RGC cresciuti con astrociti a riposo e quelli che si sono formati non hanno funzionato molto bene.
In effetti, quando i ricercatori hanno coltivato RGC sani con concentrazioni sempre più forti del brodo in cui gli A1 avevano fatto il bagno, quasi tutti gli RGC alla fine sono morti. Questo e altri esperimenti hanno dimostrato che gli A1 secernono una potente tossina che uccide i neuroni.
Lo stesso trattamento ha ucciso molti altri tipi di neuroni, inclusi sia i motoneuroni spinali che muoiono nella sclerosi laterale amiotrofica sia i neuroni dopaminergici umani la cui misteriosa perdita è la causa del morbo di Parkinson. L'acqua del bagno A1 ha anche compromesso lo sviluppo di un'altra classe di cellule cerebrali non neuronali chiamate oligodendrociti, essenzialmente flapjack pieni di grasso che si avvolgono attorno alle fibre nervose, fornendo un isolamento elettrico che accelera la propagazione del segnale a lunga distanza. La distruzione autoimmune degli oligodendrociti e il loro contenuto di grassi provoca sclerosi multipla.
In un altro esperimento, i ricercatori hanno reciso i nervi ottici dei roditori, un atto normalmente letale per le RGC, le cui fibre uscenti, chiamate assoni, costituiscono il nervo ottico. Nel sistema nervoso centrale, tagliare gli assoni fa sì che l'intero neurone muoia rapidamente, ma il motivo per cui muoiono è stato un mistero. Gli investigatori hanno determinato la causa: A1s. Hanno osservato che quegli astrociti reattivi si sono formati rapidamente dopo che gli assoni sono stati recisi, ma che il fattore di necrosi tumorale alfa (TNF-alfa), l'interleuchina-1-alfa (IL-1-alfa) e C1q con anticorpi contro queste tre sostanze hanno prevenuto la formazione di A1 e la morte di RGC negli animali.
Infine, i ricercatori hanno analizzato campioni di tessuto cerebrale umano da pazienti con morbo di Alzheimer, morbo di Parkinson, morbo di Huntington, sclerosi laterale amiotrofica e sclerosi multipla. In ogni caso, hanno osservato un gran numero di A1 preferibilmente raggruppati dove la malattia era più attiva. Ad esempio, nei campioni di pazienti affetti da Alzheimer, quasi il 60% degli astrociti presenti nella corteccia prefrontale, una regione in cui la malattia ha un grande occorrenza, erano della varietà A1. Poiché gli A1 sono altamente tossici sia per i neuroni che per gli oligodendrociti, questi risultati implicano fortemente che la formazione di A1 aiuta a guidare la neurodegenerazione in queste malattie.
È in corso uno sforzo per identificare la neurotossina secreta dagli astrociti A1, ha informato il dott. Barres. "Siamo molto entusiasti della scoperta di astrociti reattivi neurotossici", ha detto, "perché le nostre scoperte implicano che le lesioni acute della retina, del cervello e del midollo spinale e le malattie neurodegenerative possono essere tutte molto più curabili di quanto si pensasse. ”
Da:
https://www.genengnews.com/news/evil-astrocytes-emit-neuron-killing-toxin/



Commenti
Posta un commento