Forcing Fat Cells to Burn Calories / Costringere le cellule adipose a bruciare calorie
Forcing Fat Cells to Burn Calories / Costringere le cellule adipose a bruciare calorie
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
Researchers uncover the molecular pathway in brown and beige fat cells allows them to burn off calories instead of storing them as fat. / I ricercatori scoprono che il percorso molecolare nelle cellule adipose marroni e beige consente loro di bruciare calorie invece di immagazzinarle come grasso. [Cell]
With beach season in full swing, many folks would like the idea of having lipid cells be switched on to burn calories instead of storing them as fat. And though the idea of being able to eat that extra hot dog at the summer picnic and still fit into that bathing suit is appealing, there are even greater medical implications for understanding the pathways that govern fat metabolism. Now, investigators at Dana-Farber Cancer Institute in collaboration with scientists at the University of California, Berkeley, have identified a natural molecular pathway that enables lipid cells to burn off calories—raising the possibility of new treatments for obesity, diabetes, and other metabolic disorders.
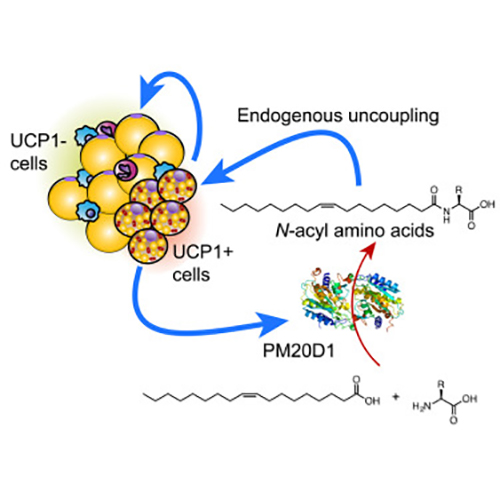
The researchers discovered the mechanism in energy-burning brown and beige fat cells in mice. Specifically, they identified an enzyme, peptidase M20 domain containing 1 (PM20D1), which was secreted by the cells and triggered the production of compounds called N-acyl amino acids. The N-acyl amino acids “uncoupled” fat burning from other metabolic processes—allowing for weight loss in the mice. Other such uncoupling compounds have been synthesized chemically. However, this is the first known natural small molecule with uncoupling activity.
Amazingly, when the scientists injected the N-acyl amino acids into obese mice that ate a high-fat diet, the researchers noted significant weight loss after 8 days of treatment. The weight loss was entirely in fatty tissue.
“Here, we identify a secreted enzyme, peptidase M20 domain containing 1 (PM20D1), that is enriched in UCP1+ [uncoupling protein 1-positive] versus UCP1– adipocytes,” the author wrote. “We demonstrate that PM20D1 is a bidirectional enzyme in vitro, catalyzing both the condensation of fatty acids and amino acids to generate N-acyl amino acids and also the reverse hydrolytic reaction. N-acyl amino acids directly bind mitochondria and function as endogenous uncouplers of UCP1-independent respiration.”
The findings from this study were published recently in Cell through an article entitled “The Secreted Enzyme PM20D1 Regulates Lipidated Amino Acid Uncouplers of Mitochondria.”
Brown fat—the color resulting from the large numbers of mitochondria present in the cells—is found in animals as are small amounts in humans, including mixed in with white fat in what are called “beige” cells. Mitochondria are the site of cellular respiration, meaning the conversion of glucose (from food consumed) into the molecule adenosine triphosphate (ATP), which transports chemical energy within the cell to drive its functions.
Brown fat cells are unique in that they consume glucose without making ATP—referred to as uncoupled respiration. Instead of producing ATP, the brown cells use their energy to burn stored calories in fat, releasing significant amounts of heat in the process. It has been postulated that brown fat cells evolved to protect newborns from cold temperatures. Yet, new research suggests that brown fat can be harnessed as a treatment for obesity, and work is underway in a number of labs and companies aimed at increasing brown fat supplies in people—for example by injecting it.
“These data certainly suggest that either PM20D1 or N-acyl amino acids themselves might be used therapeutically for the treatment of obesity and other obesity-associated disorders, such as diabetes and fatty liver disease,” explained senior study author Bruce Spiegelman, Ph.D., director of the Center for Energy Metabolism and Chronic Disease at Dana-Farber, and professor of cell biology and medicine at Harvard Medical School.
Previous work suggested that a mitochondrial protein called UCP1 was the sole source of brown cells' ability to make heat without performing any work. UCP1 is found exclusively in brown and beige fat cells. Yet now, the researchers found an alternate pathway, independent of UCP1, through which the N-acyl amino acids can turn on energy burning in brown cells and also in the liver.
“These data identify an enzymatic node and a family of metabolites that regulate energy homeostasis. This pathway might be useful for treating obesity and associated disorders,” the authors concluded.
ITALIANO
Con la stagione balneare in pieno svolgimento, molte persone vorrebbero avere l'idea di attivare le cellule lipidiche per bruciare calorie invece di immagazzinarle come grassi. E sebbene l'idea di poter mangiare quell'hot dog in più durante il picnic estivo e di indossare ancora quel costume da bagno sia allettante, ci sono anche maggiori implicazioni mediche per la comprensione dei percorsi che governano il metabolismo dei grassi. Ora, i ricercatori del Dana-Farber Cancer Institute in collaborazione con gli scienziati dell'Università della California, Berkeley, hanno identificato un percorso molecolare naturale che consente alle cellule lipidiche di bruciare calorie, aumentando la possibilità di nuovi trattamenti per l'obesità, il diabete e altre malattie metaboliche. disturbi.
I ricercatori hanno scoperto il meccanismo delle cellule adipose brune e beige che bruciano energia nei topi. Nello specifico, hanno identificato un enzima, il dominio della peptidasi M20 contenente 1 (PM20D1), che è stato secreto dalle cellule e ha attivato la produzione di composti chiamati amminoacidi N-acilici. Gli amminoacidi N-acilici "disaccoppiano" la combustione dei grassi da altri processi metabolici, consentendo la perdita di peso nei topi. Altri composti di disaccoppiamento di questo tipo sono stati sintetizzati chimicamente. Tuttavia, questa è la prima piccola molecola naturale conosciuta con attività di disaccoppiamento.
Sorprendentemente, quando gli scienziati hanno iniettato gli amminoacidi N-acil in topi obesi che seguivano una dieta ricca di grassi, i ricercatori hanno notato una significativa perdita di peso dopo 8 giorni di trattamento. La perdita di peso è stata interamente nel tessuto adiposo.
"Qui, identifichiamo un enzima secreto, il dominio della peptidasi M20 contenente 1 (PM20D1), che è arricchito in UCP1 + [proteina disaccoppiante 1 positiva] rispetto a UCP1– adipociti", ha scritto l'autore. “Dimostriamo che il PM20D1 è un enzima bidirezionale in vitro, che catalizza sia la condensazione di acidi grassi e amminoacidi per generare amminoacidi N-acilici sia la reazione idrolitica inversa. Gli amminoacidi N-acil si legano direttamente ai mitocondri e funzionano come separatori endogeni della respirazione indipendente da UCP1 ".
I risultati di questo studio sono stati pubblicati di recente su Cell attraverso un articolo intitolato "L'enzima secreto PM20D1 regola i disaccoppiatori di amminoacidi lipidati dei mitocondri".
Il grasso bruno, il colore risultante dal gran numero di mitocondri presenti nelle cellule, si trova negli animali così come piccole quantità negli esseri umani, incluso il grasso bianco in quelle che vengono chiamate cellule "beige". I mitocondri sono il sito della respirazione cellulare, ovvero la conversione del glucosio (dal cibo consumato) nella molecola di adenosina trifosfato (ATP), che trasporta l'energia chimica all'interno della cellula per guidare le sue funzioni.
Le cellule adipose brune sono uniche in quanto consumano glucosio senza produrre ATP, noto come respirazione disaccoppiata. Invece di produrre ATP, le cellule brune usano la loro energia per bruciare le calorie immagazzinate nei grassi, rilasciando quantità significative di calore nel processo. È stato ipotizzato che le cellule di grasso bruno si siano evolute per proteggere i neonati dal freddo. Tuttavia, una nuova ricerca suggerisce che il grasso bruno può essere utilizzato come trattamento per l'obesità, e in numerosi laboratori e aziende sono in corso lavori volti ad aumentare le scorte di grasso bruno nelle persone, ad esempio iniettandolo.
"Questi dati suggeriscono certamente che il PM20D1 o gli stessi amminoacidi N-acilici potrebbero essere utilizzati terapeuticamente per il trattamento dell'obesità e di altri disturbi associati all'obesità, come il diabete e la malattia del fegato grasso", ha spiegato l'autore senior dello studio Bruce Spiegelman, Ph.D ., direttore del Center for Energy Metabolism and Chronic Disease a Dana-Farber e professore di biologia cellulare e medicina presso la Harvard Medical School.
Il lavoro precedente ha suggerito che una proteina mitocondriale chiamata UCP1 fosse l'unica fonte della capacità delle cellule brune di produrre calore senza eseguire alcun lavoro. UCP1 si trova esclusivamente nelle cellule adipose brune e beige. Eppure ora, i ricercatori hanno trovato un percorso alternativo, indipendente da UCP1, attraverso il quale gli amminoacidi N-acilici possono attivare la combustione di energia nelle cellule brune e anche nel fegato.
“Questi dati identificano un nodo enzimatico e una famiglia di metaboliti che regolano l'omeostasi energetica. Questo percorso potrebbe essere utile per il trattamento dell'obesità e dei disturbi associati ", hanno concluso gli autori.
Da:
https://www.genengnews.com/topics/drug-discovery/forcing-fat-cells-to-burn-calories/



Commenti
Posta un commento