Role of Tissue Engineering in COVID-19 and Future Viral Outbreaks / Ruolo dell'ingegneria dei tessuti in COVID-19 e future epidemie virali
Role of Tissue Engineering in COVID-19 and Future Viral Outbreaks / Ruolo dell'ingegneria dei tessuti in COVID-19 e future epidemie virali
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
Abstract
In light of the current novel coronavirus (COVID-19) pandemic, as well as other viral outbreaks in the 21st century, there is a dire need for new diagnostic and therapeutic strategies to combat infectious diseases worldwide. As a convergence science, tissue engineering has traditionally focused on the application of engineering principles to biological systems, collaboration across disciplines, and rapid translation of technologies from the benchtop to the bedside. Given these strengths, tissue engineers are particularly well suited to apply their skill set to the current crisis and viral outbreaks in general. This work introduces the basics of virology and epidemiology for tissue engineers, and highlights important developments in the field of tissue engineering relevant to the current pandemic, including in vitro model systems, vaccine technology, and small-molecule drug delivery. COVID-19 serves as a call to arms for scientists across all disciplines, and tissue engineers are well trained to be leaders and contributors in this time of need.
Impact statement
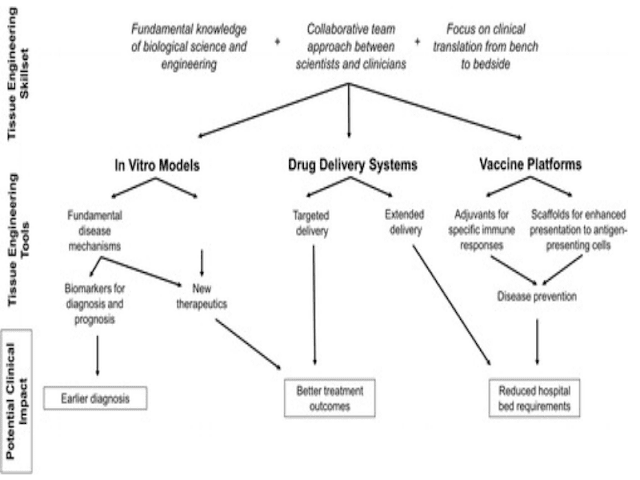
Given the steep mortality caused by the recent novel coronavirus (COVID-19) pandemic, there is clear need for advances in diagnostics and therapeutics for viral outbreaks. Tissue engineering has the potential for critical impact on clinical outcomes in viral outbreaks. Tissue engineers, if mobilized, could play key roles as leaders in the outbreak, given their ability to apply engineering principles to biological processes, experience in collaborative environments, and penchant for technological translation from benchtop to bedside. In this work, three areas pioneered by tissue engineers that could be applied to the current COVID-19 crisis and future viral outbreaks are highlighted.
Introduction
As of April 2020, the world is facing a pandemic of unfathomable proportions. As per the World Health Organization (WHO) on April 9, more than 1,500,000 patients worldwide have been diagnosed with the novel coronavirus disease 2019 (COVID-2019) caused by a laboratory-confirmed infection of the Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2), with more than 84,000 global deaths at this time. Our hospital systems are rapidly filling with patients suffering from viral illness, and the capacity of resources such as emergency departments, inpatient wards, and intensive care units (ICUs) has become overwhelmed in some regions. There is a dire need for new diagnostic and therapeutic modalities. Early diagnosis is critical in establishing quarantine and limiting the spread of outbreaks; diagnostics later in the course of an epidemic remain important, particularly in determining established immunity. For those infected, there is a current paucity in validated antiviral therapies, and there is no vaccine at this time, although multiple efforts are under way. Even after the predicted resolution of COVID-19, the increasing frequency of viral outbreaks (including the 2003 Severe Acute Respiratory Syndrome Coronavirus, 2014 Ebola virus, 2015 Middle Eastern Respiratory Syndrome Coronavirus, and 2015 Zika virus outbreaks) suggests that new mechanisms to combat viral infections are a high priority.
As a convergence science, tissue engineering is uniquely suited to offer solutions to complex clinical questions. Currently, tissue engineering–based technologies are being developed to revolutionize areas in medicine such as high-throughput drug discovery, personalized cancer therapy, immune modulation, and organ transplantation. Tissue engineers specialize in the application of engineering principles to biological systems, which facilitates the generation of fundamental knowledge as well as new technologies that could be key in a pandemic. In addition, tissue engineers are well versed in collaborative models, working closely alongside clinicians, biologists, chemists, physicists, mathematicians, veterinarians, and other specialists, which will be critical in a multidisciplinary approach to combating the virus known as SARS-CoV-2. Lastly, tissue engineering as a field has emphasized clinical translation, including creating workflows to optimize bringing the benchtop to the bedside, resulting in a $9 billion market, with 21 companies selling tissue engineering–based products in the United States alone as of 2017. In the current setting of limited clinical data and rising patient morbidity and mortality, tissue engineers would be welcomed and valuable allies in the COVID-19 pandemic.
In this work, the potential impact of tissue engineering in improving clinical outcomes during the COVID-19 pandemic and future viral epidemics is explored. Relevant background information regarding SARS-CoV-2 is briefly reviewed, and pertinent tissue engineering work is highlighted, including development of viral in vitro models, drug delivery systems, and vaccine platforms. Given the current state of the pandemic, it may be challenging to mobilize new efforts within the tissue engineering community in time to change practice in health care. New in vitro models, diagnostics, and therapeutics will need to be validated prior to safe implementation at the clinical level. In addition, many major academic centers are currently at limited capacity due to precautions to limit the spread of the pandemic. However, COVID-19 can act as a representative outbreak for which tissue engineers can learn from and begin preparations to lead the way to prevent and treat the next viral epidemic better.
Our current understanding of SARS-CoV-2 is evolving and incomplete. The following information is based on current evidence and will likely change as the virus is more closely studied. Given the urgency of the pandemic, some of the references in this work have yet to receive peer review and should be interpreted with caution.
SARS-CoV-2 Background
Coronaviruses, or Orthocoronavirinae, are enveloped single-stranded RNA viruses. The virus gets its name from the projections, or “spikes,” emerging from its envelope that appear crown-like on electron micrography. The major components of SARS-CoV-2 are the envelope protein (E), membrane glycoprotein (M), spike protein (S), nucleocapsid protein (N), and its relatively large RNA genome of ∼30 kb. Enveloped viruses have a protective lipid bilayer with surface proteins and are generally more vulnerable to harsh environments than non-enveloped viruses. The spike protein is supposed to interact with human angiotensin-converting enzyme 2 (ACE2) membrane protein to induce fusion, endocytosis, and subsequent invasion into the host cell. Coronaviruses escape endosomes to the cytoplasm via acid-dependent cleavage of the S protein. RNA viruses, with few exceptions, replicate in the cytoplasm. The virus takes advantage of host ribosomes to replicate by translation and then assembly in the endoplasmic reticulum directed by M and E protein interactions. Viruses are then released by exocytosis to repeat the cycle of infection. Given this pathophysiology, potential targets being explored as therapeutics agents include blocking ACE2 interactions, altering endosome pH to prevent escape, inhibiting viral and/or host enzymes critical to replication, and downregulating host inflammation, given that an overexuberant response may lead to acute respiratory distress syndrome (ARDS).
SARS-CoV-2 has the highest viral burden in the nares rather than the throat and is thought to be spread during coughing and aerosolization of droplets. Compared to SARS-CoV-1, spread of the virus appears to be more rapid due to higher asymptomatic carrier rates and a longer incubation time prior to symptom onset. Initial symptoms commonly include fever, cough, and fatigue and, less commonly, gastrointestinal manifestations. Current biomarkers suggestive of infection include elevated lactate dehydrogenase, ferritin, D-dimer, erythrocyte sedimentation rate, C-reactive protein, and absolute lymphopenia. In the United States, the most widely available diagnostic test is polymerase chain reaction based, although antibody-based assays are in development and are available in other countries. The virus primarily affects the lungs, causing ARDS in up to 5–10% of infected patients, although it has also been causing myocardial injury suspected to be due to high concentrations of ACE2 in cardiac tissue. Mortality is estimated to be 3–4%. Given the extreme global morbidity and mortality caused by the pandemic, there is a dire need for a better understanding of molecular mechanisms of host–virus interaction, more rapid methods to screen potential therapeutics, and platforms to facilitate safe clinical translation. These are all areas in which tissue engineers are primed to make significant contributions for COVID-19, the next coronavirus epidemic, or other future viral outbreaks.
In Vitro Models
Development of physiologically representative in vitro models of viral disease can assist in two critical roles during a pandemic:
(1) better characterization and understanding of the host–pathogen interface and mechanisms of infection;
(2) as a platform for high-throughput screening of potential therapeutics.
Currently, it is challenging and clinically necessary to predict the course of patients infected with SARS-CoV-2. Profiling biomarkers may allow for better risk stratification and resource allotment. More accurate in vitro modeling to understand host response as well as viral mechanisms for transmission and replication is critical for the identification of biomarkers to pursue as hypothesis-driven diagnostic and therapeutic targets. In addition, a physiologically relevant in vitro model has the potential to fill the critical need for improved drug candidate screening.
The current gold standard for screening antiviral therapeutics is based on static monolayer culture of Vero cells, an interferon-deficient aneuploid line of kidney epithelial cells originally isolated from an African green monkey. In a recent study, Vero cells were exposed to a library of 3000 drugs approved by the Food and Drug Administration and the Investigational New Drug program and then infected with SARS-CoV-2 to screen for potential therapeutics. Because Vero cells lack interferon, they are highly susceptible to viruses and allow for replication, and so they have been an attractive vehicle to screen compounds. However, interferon itself is an important regulator of host binding proteins involved in SARS-CoV-2. In general, the relevance of a drug's ability to inhibit viral infection of a malignant nonhuman primate (NHP) kidney cell lacking interferon production is uncertain. For example, while the antidepressant sertraline was found to have potent in vitro activity against Ebola in the Vero cell model, later testing in an in vivo NHP model failed to show protection against Ebola. Static cultures of xenograft monolayers fail to replicate many of the conditions facing viruses in vivo, including realistic extracellular matrix (ECM), three-dimensional cell–cell interfaces, and shear forces. Coronaviruses and other respiratory viruses, for example, can bind to the ECM components such as sialic acid to assist in infection of the host.
In the last decade, tissue engineering has made significant advances regarding in vitro human cell culture models. Developments of induced pluripotent stem cells, CRISPR-Cas, microfluidics, 3D printing, and biomaterials have led to technologies such as tissue-on-a-chip and advanced bioreactor models containing co-cultures of cells from ectodermal, mesodermal, and endodermal lineages. These models, utilizing human cells, have been able to mimic complex pathophysiology such as generation of pulmonary edema upon exposure to inflammatory signals such as interleukin-2. For example, in a model to study influenza A virus, 3D tissue-engineered constructs more accurately recapitulated the host morphology of cultured human epithelial airway cells compared to 2D culture, and infection with major influenza strains resulted in upregulation of proinflammatory cytokines. One coronavirus-specific example of a tissue-engineered platform in which respiratory viruses have been studied is the rotation wall vessel bioreactor. These models simulate low physiologic shear stresses and frequently incorporate multiple pulmonary cell types, including co-culture of human mesenchymal bronchial tracheal cells and human bronchial epithelial cells, challenging them against respiratory syncytial virus and SARS-CoV-1. Unfortunately, SARS-CoV-1 did not replicate in this study. In another model, human pulmonary epithelial progenitor cells were grown on a collagen matrix in a serum-free media with a mesenchymal stroma and exposed to virus. It was demonstrated that stem cells were targeted by SARS-CoV-1, which may suggest why normal lung regeneration following viral infection is challenging.
There are a number of exciting tissue-engineered human in vitro lung models currently available that could be leveraged for studying viral infection and established in vivo models for respiratory viruses, including NHPs, already in use Elements that may improve the relevance of in vitro models include:
(1) human rather than animal cell lines;
(2) co-culture of multiple pulmonary cell lines;
(3) 3D scaffolds that mimic native pulmonary architecture
(4) culture methods that permit generation of ECM prior to viral inoculation.
Additional head-to-head studies will need to be performed to determine if these components are necessary to capture the pathophysiology of viral infection. These platforms will be important in conducting hypothesis-driven research to understand the host–pathogen interface. Scaling these models to allow for high-throughput drug screening will offer important advantages over the current Vero-based methods to identify therapeutic candidates for in vivo translation rapidly during major infectious outbreaks.
Drug Delivery Systems
During the COVID-19 pandemic, one of the most significant strains on the health-care system has been the need for inpatient beds, both on general wards and in ICUs. As discussed previously regarding in vitro drug screens, there are currently limited therapeutics that have clear clinical evidence of improving outcomes such as days of hospitalization required, need for ICU stay, and need for intubation/ventilation. As new small molecule–based therapies come through the pipeline, tissue engineers can continue to design drug delivery systems to (1) target medications to specific organ systems to increase bioavailability, and (2) extend the release of medications so that frequent administration is not necessary.
Classes of molecules that have been suggested as possible therapies include repurposed small-molecule drugs, monoclonal antibodies, and oligonucleotide strategies. For example, based on a small clinical study, the combination of hydroxychloroquine (a small molecule traditionally used to treat malaria and lupus) and azithromycin (a macrolide antibiotic with anti-inflammatory properties) has been suggested as a means to reduce SARS-CoV-2 viral load, although these results are controversial. Poly(lactide) and poly(lactide-co-glycolide) (PLGA) microparticles can deliver azithromycin for up to 60 days with zero-order release kinetics. There are also formulations using fumaryl diketopiperazine microparticles to deliver azithromycin via intratracheal insufflation directly to the lungs, resulting in higher local concentrations in a murine pneumonia model compared to oral and intravenous routes of delivery. Given that the half-life of hydroxychloroquine is >40 days, extended drug delivery options may not be warranted. However, there have been successful delivery systems constructed from PLGA nanoparticles for specific cell targeting.While the efficacy of hydroxychloroquine and azithromycin in the prevention and treatment of SARS-CoV-2 remains an area of active study, the above examples serve to show that tissue engineers and biomaterials scientists have been working on drug delivery for decades with a variety of vehicles available for small molecules in general.
In addition to small molecules, monoclonal antibodies are an exciting class of medication, given their success in the treatment of Ebola virus.Antibodies are a natural part of humoral immunity and can be engineered to block specific ligands or receptors vital for viral function. These therapies generally need to be delivered intravenously to be successful. In the Ebola virus studies, for example, patients required one to three infusion sessions, depending on the antibody. A human monoclonal antibody was developed against SARS-CoV-1 and was demonstrated to be effective in a ferret model. Researchers have screened monoclonal antibodies designed against SARS-CoV-1 and have discovered cross-reactivity of at least one of the antibodies against SARS-CoV-2. Systems designs for the controlled extended release of antibodies may be advantageous over multiple infusion sessions for clinical practice. Nanoporous scaffolds coated with allylamine-based polymer were capable of releasing rituximab, a monoclonal antibody against B cells, for up to 30 days. Similarly, an alginate-based drug delivery system was able to deliver a human immunoglobulin G1 (IgG1) monoclonal antibody in a rat model for at least 28 days with a single dose of the system. In addition to the possibility of reducing administration to single dosing by extended release, there has also been development of ingestible injection systems to deliver biomacromolecules through autoinjection during gastric transit. These allowed for insulin delivery in a porcine model and may facilitate oral delivery of medications previously only efficacious in intravenous form.
Lastly, short interfering RNA (siRNA) has also been explored as both prophylaxis and therapy for coronavirus infection. For sequences specific to SARS-CoV-1, siRNA was effective in a NHP model, resulting in diminished viral load and alveolar damage. Four intranasal doses were required over 5 days in treatment arms. The researchers reported not using additional vehicles to deliver their siRNA such as polyethylenimine due to the possibility of carrier-induced lung inflammation. However, more complex vehicles have since been developed by the field specifically for pulmonary usage, including mesoporous silica nanoparticles and cationic liposomes. As siRNA sequences, specific antibodies, and small molecules are identified that specifically mitigate SARS-CoV-2, tissue engineers and biomaterials scientists can continue their work in designing vehicles to target areas of high viral load specifically and extendedly. Even if this work may not come to fruition during the current pandemic, these vehicles may serve vital roles during future viral outbreaks.
Vaccine Platforms
The ability to vaccinate against specific pathogens has played a major role in preventative medicine for the last century. Vaccines exist both for respiratory viruses such as Influenzavirus and for bacteria such as Streptococcus pneumoniae and Haemophilus influenzae. While the success of respiratory viral vaccines varies from season to season, data suggest influenza vaccination generally results in lower probability of complications, including ICU stay, mechanical ventilation, and severe outcomes, especially in patients with comorbidities such as chronic obstructive pulmonary disease. Work is already underway to develop vaccines effective against SARS-CoV-2 to prevent disease and mitigate transmission.
Successful vaccination against pathogens relies on presenting antigens and stimulating specific elements of the immune system to build recognition and memory in both humoral and cell-mediated branches. With advances in immunology, biomaterials and tissue engineering are being leveraged to elicit specific host immune responses to augment vaccination strategies. In many of these systems, the biomaterial acts as the drug delivery vehicle for the vaccine as well as the adjuvant. Furthermore, the field is characterizing how the size, shape, and other physicochemical properties of biomaterials affect the behavior of immune cells. The goals of many of these systems are to target antigen-presenting cells such as macrophages and dendritic cells and to drive specific responses such as Th1 or Th2 (different helper T classes). For example, conjugation of different receptors to protein-based particles can individually tune Th1 or Th2 response in a murine model. Biodegradable polymers, one of the primary workhorses as scaffold material in tissue engineering, have also been explored. PLGA nanoparticles drive Th1 immune response compared to no carriers and other biomaterials in a vaccine against Chagas disease in a murine model and have also been explored for targeted delivery to specific immune populations. PLGA microparticles in combination with a chitosan/peptide conjugate coating have also been used as a delivery system to target specific mucosal cells and to deliver a swine dysentery vaccine with elevated IgA and IgG production in mice. In another murine model, chitosan nanoparticles enhanced T-cell response for a Mycobacterium tuberculosis DNA vaccine. When chitosan was mannosylated to promote endocytosis, an intranasal vaccine increased IgG levels in a murine model. For influenza, chitosan has also been modified to create a thermoresponsive intranasal murine vaccine against H5N1l. Silver nanoparticles have also been used to deliver inactivated influenza vaccine locally with some specificity to lung immune cells, resulting in greater IgG titers and reduced mortality in a murine model. While there are currently fewer studies regarding coronavirus vaccines, there has been some success in mice in which nanoparticles were prepared from a SARS-CoV-1 peptide sequence, and subsequent sera was successful in preventing infection of Vero cells.
In addition to various particle-based platforms, tissue engineering strategies have been harnessed to create scaffold systems for vaccination enhancement. With specific physicochemical properties, such as pore size, and profile of released recruitment signals such as granulocyte-colony stimulating factor, scaffolds of PLGA and mesoporous silica rods have been used to recruit and concentrate antigen-presenting cells to vaccine components. This strategy has primarily been applied to tumor vaccines and has demonstrated efficacy in animal models against melanoma and intracranial gliomas. It is currently undergoing a Phase I clinical trial of 23 patients with melanoma, which is estimated to complete in June 2020 (NCT01753089; ClinicalTrials.gov). This platform of scaffold-based vaccination has also shown efficacy against bacterial pathogens in porcine and murine models. Other examples of scaffold-based vaccine systems include those generated from respiratory syncytial virus that were effective in mice as well NHPs. These particle-based and scaffold-based vaccine systems may be promising in translation against SARS-CoV-2. However, the majority have only been studied in mouse models at this point in time, and significant translational efforts will need to be undertaken for clinical trials. Modular platforms in which different antigens can be plugged in may be very useful for rapid vaccine development in future pandemics.
Conclusion
The world faces a global health-care crisis of unheralded magnitude. The rate of infection and mortality from COVID-19 make it unlike any virus seen in this century. Physicians and scientists are banding together to combat the threat of SAR-CoV-2. Tissue engineers have a rare set of tools and can make substantial contributions to our understanding of viral disease and contribute toward the critical development of diagnostic and therapeutic platforms. Together, we can overcome this current pandemic and work to prevent and mitigate future viral outbreaks.
ITALIANO
Riassunto
Alla luce dell'attuale nuova pandemia di coronavirus (COVID-19) e di altri focolai virali nel 21 ° secolo, c'è un disperato bisogno di nuove strategie diagnostiche e terapeutiche per combattere le malattie infettive in tutto il mondo. In quanto scienza di convergenza, l'ingegneria dei tessuti si è tradizionalmente concentrata sull'applicazione dei principi di ingegneria ai sistemi biologici, sulla collaborazione tra le discipline e sulla rapida traduzione delle tecnologie dal banco al letto del paziente. Dati questi punti di forza, gli ingegneri dei tessuti sono particolarmente adatti ad applicare le loro competenze alla crisi attuale e alle epidemie virali in generale. Questo lavoro introduce le basi della virologia e dell'epidemiologia per gli ingegneri dei tessuti e mette in evidenza importanti sviluppi nel campo dell'ingegneria dei tessuti rilevanti per l'attuale pandemia, compresi i sistemi modello in vitro, la tecnologia dei vaccini e la somministrazione di farmaci a piccole molecole. COVID-19 funge da richiamo alle armi per scienziati di tutte le discipline e gli ingegneri dei tessuti sono ben addestrati per essere leader e contributori in questo momento di bisogno.
Dichiarazione d'impatto
Data la forte mortalità causata dalla recente nuova pandemia di coronavirus (COVID-19), è evidente la necessità di progressi nella diagnostica e nella terapia per le epidemie virali. L'ingegneria dei tessuti ha il potenziale per un impatto critico sugli esiti clinici nelle epidemie virali. Gli ingegneri dei tessuti, se mobilitati, potrebbero svolgere un ruolo chiave come leader nell'epidemia, data la loro capacità di applicare i principi di ingegneria ai processi biologici, l'esperienza in ambienti collaborativi e la propensione alla traduzione tecnologica dal banco al letto del paziente. In questo lavoro, vengono evidenziate tre aree sperimentate dagli ingegneri dei tessuti che potrebbero essere applicate all'attuale crisi COVID-19 e ai futuri focolai virali.
Introduzione
A partire da aprile 2020, il mondo sta affrontando una pandemia di proporzioni insondabili. Secondo l'Organizzazione mondiale della sanità (OMS) il 9 aprile, a più di 1.500.000 pazienti in tutto il mondo è stata diagnosticata la nuova malattia da coronavirus 2019 (COVID-2019) causata da un'infezione confermata dal laboratorio della sindrome respiratoria acuta grave Coronavirus 2 (SARS- CoV-2), con oltre 84.000 morti globali in questo momento. I nostri sistemi ospedalieri si stanno rapidamente riempiendo di pazienti affetti da malattie virali e la capacità di risorse come reparti di emergenza, reparti di degenza e unità di terapia intensiva (ICU) è stata sopraffatta in alcune regioni. C'è un disperato bisogno di nuove modalità diagnostiche e terapeutiche. La diagnosi precoce è fondamentale per stabilire la quarantena e limitare la diffusione dei focolai; la diagnostica successiva nel corso di un'epidemia rimane importante, in particolare per determinare l'immunità stabilita. Per le persone infette, c'è una scarsità di terapie antivirali convalidate e al momento non esiste un vaccino, sebbene siano in corso molteplici sforzi. Anche dopo la prevista risoluzione di COVID-19, la crescente frequenza di epidemie virali (tra cui il Coronavirus della sindrome respiratoria acuta grave del 2003, il virus Ebola del 2014, il Coronavirus della sindrome respiratoria mediorientale del 2015 e il virus Zika del 2015) suggerisce che nuovi meccanismi per combattere i virus virali le infezioni sono una priorità assoluta.
In quanto scienza della convergenza, l'ingegneria dei tessuti è particolarmente adatta per offrire soluzioni a complesse questioni cliniche. Attualmente, le tecnologie basate sull'ingegneria dei tessuti vengono sviluppate per rivoluzionare aree della medicina come la scoperta di farmaci ad alto rendimento, la terapia del cancro personalizzata, la modulazione immunitaria e il trapianto di organi. Gli ingegneri dei tessuti sono specializzati nell'applicazione di principi di ingegneria ai sistemi biologici, il che facilita la generazione di conoscenze fondamentali e nuove tecnologie che potrebbero essere fondamentali in una pandemia. Inoltre, gli ingegneri dei tessuti sono esperti in modelli collaborativi, lavorando a stretto contatto con medici, biologi, chimici, fisici, matematici, veterinari e altri specialisti, che saranno fondamentali in un approccio multidisciplinare alla lotta contro il virus noto come SARS-CoV-2 . Infine, l'ingegneria dei tessuti come campo ha enfatizzato la traduzione clinica, inclusa la creazione di flussi di lavoro per ottimizzare il posizionamento del banco al letto del paziente, risultando in un mercato da 9 miliardi di dollari, con 21 aziende che vendono prodotti basati sull'ingegneria tissutale solo negli Stati Uniti a partire dal 2017. Nell'attuale impostazione di dati clinici limitati e l'aumento della morbilità e mortalità dei pazienti, gli ingegneri dei tessuti sarebbero i benvenuti e preziosi alleati nella pandemia COVID-19.
In questo lavoro, viene esplorato il potenziale impatto dell'ingegneria dei tessuti nel migliorare i risultati clinici durante la pandemia COVID-19 e le future epidemie virali. Le informazioni di base relative a SARS-CoV-2 vengono brevemente esaminate e viene evidenziato il lavoro di ingegneria dei tessuti pertinente, compreso lo sviluppo di modelli virali in vitro, sistemi di somministrazione di farmaci e piattaforme di vaccini. Dato lo stato attuale della pandemia, potrebbe essere difficile mobilitare nuovi sforzi all'interno della comunità dell'ingegneria dei tessuti in tempo per cambiare la pratica nell'assistenza sanitaria. Nuovi modelli in vitro, diagnosi e terapie dovranno essere convalidati prima dell'implementazione sicura a livello clinico. Inoltre, molti dei principali centri accademici hanno attualmente una capacità limitata a causa delle precauzioni per limitare la diffusione della pandemia. Tuttavia, COVID-19 può fungere da focolaio rappresentativo da cui gli ingegneri dei tessuti possono apprendere e iniziare i preparativi per aprire la strada alla prevenzione e al trattamento migliore della prossima epidemia virale.
La nostra attuale comprensione di SARS-CoV-2 è in evoluzione e incompleta. Le seguenti informazioni si basano su prove attuali e probabilmente cambieranno quando il virus verrà studiato più da vicino. Data l'urgenza della pandemia, alcuni dei riferimenti in questo lavoro devono ancora ricevere una revisione tra pari e dovrebbero essere interpretati con cautela.
Sfondo di SARS-CoV-2
I coronavirus, o Orthocoronavirinae, sono virus a RNA a filamento singolo avvolti. Il virus prende il nome dalle proiezioni, o "picchi", che emergono dal suo involucro che appaiono a forma di corona sulla micrografia elettronica. I componenti principali di SARS-CoV-2 sono la proteina dell'involucro (E), la glicoproteina di membrana (M), la proteina spike (S), la proteina nucleocapsidica (N) e il suo genoma RNA relativamente grande di ∼30 kb. I virus avvolti hanno un doppio strato lipidico protettivo con proteine di superficie e sono generalmente più vulnerabili agli ambienti ostili rispetto ai virus senza involucro. La proteina spike dovrebbe interagire con la proteina di membrana dell'enzima di conversione dell'angiotensina 2 (ACE2) umana per indurre la fusione, l'endocitosi e la successiva invasione nella cellula ospite. I coronavirus sfuggono agli endosomi nel citoplasma tramite la scissione acido-dipendente della proteina S. I virus a RNA, con poche eccezioni, si replicano nel citoplasma. Il virus sfrutta i ribosomi dell'ospite per replicarsi mediante traduzione e quindi assemblaggio nel reticolo endoplasmatico diretto dalle interazioni delle proteine M ed E. I virus vengono quindi rilasciati dall'esocitosi per ripetere il ciclo di infezione. Data questa fisiopatologia, i potenziali bersagli esplorati come agenti terapeutici includono il blocco delle interazioni ACE2, l'alterazione del pH dell'endosoma per prevenire la fuga, l'inibizione di enzimi virali e / o dell'ospite critici per la replicazione e la sottoregolazione dell'infiammazione dell'ospite, dato che una risposta eccessiva può portare a distress respiratorio acuto sindrome (ARDS).
Il SARS-CoV-2 ha il carico virale più elevato nelle narici piuttosto che nella gola e si pensa che si diffonda durante la tosse e l'aerosol delle goccioline. Rispetto al SARS-CoV-1, la diffusione del virus sembra essere più rapida a causa di tassi di portatori asintomatici più elevati e di un tempo di incubazione più lungo prima dell'insorgenza dei sintomi. I sintomi iniziali comunemente includono febbre, tosse e affaticamento e, meno comunemente, manifestazioni gastrointestinali. Gli attuali biomarcatori indicativi di infezione includono lattato deidrogenasi, ferritina, D-dimero, velocità di eritrosedimentazione, proteina C-reattiva e linfopenia assoluta. Negli Stati Uniti, il test diagnostico più ampiamente disponibile è basato sulla reazione a catena della polimerasi, sebbene i test basati sugli anticorpi siano in fase di sviluppo e siano disponibili in altri paesi. Il virus colpisce principalmente i polmoni, causando ARDS fino al 5-10% dei pazienti infetti, sebbene abbia anche causato un danno miocardico sospettato di essere dovuto ad alte concentrazioni di ACE2 nel tessuto cardiaco. Si stima che la mortalità sia del 3-4%. Data l'estrema morbilità e mortalità globale causata dalla pandemia, c'è un disperato bisogno di una migliore comprensione dei meccanismi molecolari dell'interazione ospite-virus, metodi più rapidi per lo screening di potenziali terapie e piattaforme per facilitare la traduzione clinica sicura. Queste sono tutte aree in cui gli ingegneri dei tessuti sono pronti a dare un contributo significativo per COVID-19, la prossima epidemia di coronavirus o altri futuri focolai virali.
Modelli in vitro
Lo sviluppo di modelli in vitro fisiologicamente rappresentativi di malattia virale può aiutare in due ruoli critici durante una pandemia:
(1) migliore caratterizzazione e comprensione dell'interfaccia ospite-patogeno e dei meccanismi di infezione;
(2) come piattaforma per lo screening ad alto rendimento di potenziali terapie.
Attualmente, è difficile e clinicamente necessario prevedere il decorso dei pazienti infetti da SARS-CoV-2. Il profilo dei biomarcatori può consentire una migliore stratificazione del rischio e assegnazione delle risorse. Una modellazione in vitro più accurata per comprendere la risposta dell'ospite nonché i meccanismi virali per la trasmissione e la replicazione è fondamentale per l'identificazione dei biomarcatori da perseguire come obiettivi diagnostici e terapeutici basati su ipotesi. Inoltre, un modello in vitro fisiologicamente rilevante ha il potenziale per soddisfare la necessità critica di un migliore screening dei candidati ai farmaci.
L'attuale gold standard per lo screening delle terapie antivirali si basa sulla coltura statica monostrato di cellule Vero, una linea aneuploide di cellule epiteliali renali carente di interferone originariamente isolata da una scimmia verde africana. In un recente studio, le cellule Vero sono state esposte a una libreria di 3000 farmaci approvati dalla Food and Drug Administration e dal programma Investigational New Drug e quindi infettate con SARS-CoV-2 per lo screening di potenziali terapie. Poiché le cellule Vero mancano di interferone, sono altamente suscettibili ai virus e consentono la replicazione, quindi sono state un veicolo attraente per schermare i composti. Tuttavia, l'interferone stesso è un importante regolatore delle proteine che legano l'ospite coinvolte nella SARS-CoV-2. In generale, la rilevanza della capacità di un farmaco di inibire l'infezione virale di una cellula renale di primati non umani maligni (NHP) priva di produzione di interferone è incerta. Ad esempio, mentre si è scoperto che l'antidepressivo sertralina ha una potente attività in vitro contro l'Ebola nel modello cellulare Vero, test successivi in un modello NHP in vivo non sono riusciti a dimostrare protezione contro l'Ebola. Le colture statiche di monostrati di xenotrapianto non riescono a replicare molte delle condizioni che devono affrontare i virus in vivo, inclusa la matrice extracellulare realistica (ECM), le interfacce cellula-cellula tridimensionali e le forze di taglio. I coronavirus e altri virus respiratori, ad esempio, possono legarsi ai componenti dell'ECM come l'acido sialico per favorire l'infezione dell'ospite.
Nell'ultimo decennio, l'ingegneria dei tessuti ha compiuto progressi significativi per quanto riguarda i modelli di colture cellulari umane in vitro. Gli sviluppi di cellule staminali pluripotenti indotte, CRISPR-Cas, microfluidica, stampa 3D e biomateriali hanno portato a tecnologie come i modelli tissue-on-a-chip e di bioreattori avanzati contenenti co-colture di cellule di lignaggi ectodermici, mesodermici ed endodermici. Questi modelli, utilizzando cellule umane, sono stati in grado di imitare una fisiopatologia complessa come la generazione di edema polmonare in seguito all'esposizione a segnali infiammatori come l'interleuchina-2. Ad esempio, in un modello per studiare il virus dell'influenza A, i costrutti di ingegneria tessutale 3D ricapitolano in modo più accurato la morfologia dell'ospite delle cellule delle vie aeree epiteliali umane coltivate rispetto alla coltura 2D e l'infezione con i principali ceppi influenzali ha provocato una sovraregolazione delle citochine proinfiammatorie. Un esempio specifico del coronavirus di una piattaforma di ingegneria tissutale in cui sono stati studiati i virus respiratori è il bioreattore del vaso con parete di rotazione. Questi modelli simulano basse sollecitazioni di taglio fisiologiche e spesso incorporano più tipi di cellule polmonari, inclusa la co-coltura di cellule tracheali bronchiali mesenchimali umane e cellule epiteliali bronchiali umane, sfidandole contro il virus respiratorio sinciziale e SARS-CoV-1. Sfortunatamente, il SARS-CoV-1 non si è replicato in questo studio. In un altro modello, cellule progenitrici epiteliali polmonari umane sono state coltivate su una matrice di collagene in un terreno privo di siero con uno stroma mesenchimale ed esposte al virus. È stato dimostrato che le cellule staminali sono state prese di mira da SARS-CoV-1, il che potrebbe suggerire perché la normale rigenerazione polmonare a seguito di infezione virale sia difficile.
Attualmente sono disponibili numerosi modelli di polmoni umani in vitro con ingegneria tissutale che potrebbero essere utilizzati per lo studio dell'infezione virale e modelli in vivo stabiliti per i virus respiratori, inclusi gli NHP, già in uso Elementi che possono migliorare la rilevanza dei modelli in vitro includono :
(1) linee cellulari umane piuttosto che animali;
(2) co-coltura di più linee cellulari polmonari;
(3) impalcature 3D che imitano l'architettura polmonare nativa
(4) metodi di coltura che consentono la generazione di ECM prima dell'inoculazione virale.
Sarà necessario eseguire ulteriori studi testa a testa per determinare se questi componenti sono necessari per acquisire la fisiopatologia dell'infezione virale. Queste piattaforme saranno importanti per condurre ricerche basate su ipotesi per comprendere l'interfaccia ospite-patogeno. Il ridimensionamento di questi modelli per consentire uno screening dei farmaci ad alto rendimento offrirà importanti vantaggi rispetto agli attuali metodi basati su Vero per identificare rapidamente i candidati terapeutici per la traduzione in vivo durante le principali epidemie infettive.
Sistemi di somministrazione di farmaci
Durante la pandemia COVID-19, uno dei problemi più significativi sul sistema sanitario è stata la necessità di letti per degenti, sia nei reparti generali che nelle unità di terapia intensiva. Come discusso in precedenza per quanto riguarda gli screening dei farmaci in vitro, attualmente ci sono terapie limitate che hanno chiare prove cliniche di miglioramento dei risultati come i giorni di ospedalizzazione richiesti, la necessità di ricovero in terapia intensiva e la necessità di intubazione / ventilazione. Con l'arrivo di nuove terapie a base di piccole molecole, gli ingegneri dei tessuti possono continuare a progettare sistemi di somministrazione di farmaci per
(1) indirizzare i farmaci a sistemi di organi specifici per aumentare la biodisponibilità
(2) estendere il rilascio di farmaci in modo che non sia una somministrazione frequente. necessario.
Le classi di molecole che sono state suggerite come possibili terapie includono farmaci a piccole molecole riproposti, anticorpi monoclonali e strategie oligonucleotidiche. Ad esempio, sulla base di un piccolo studio clinico, è stata suggerita la combinazione di idrossiclorochina (una piccola molecola tradizionalmente utilizzata per il trattamento della malaria e del lupus) e dell'azitromicina (un antibiotico macrolidico con proprietà antinfiammatorie) come mezzo per ridurre la SARS-CoV. -2 carica virale, sebbene questi risultati siano controversi. Le microparticelle poli (lattide) e poli (lattide-co-glicolide) (PLGA) possono rilasciare azitromicina fino a 60 giorni con cinetica di rilascio di ordine zero. Esistono anche formulazioni che utilizzano microparticelle di fumaril dichetopiperazina per fornire azitromicina tramite insufflazione intratracheale direttamente ai polmoni, con conseguenti concentrazioni locali più elevate in un modello di polmonite murino rispetto alle vie di consegna orale ed endovenosa. Dato che l'emivita dell'idrossiclorochina è> 40 giorni, le opzioni di somministrazione del farmaco estese potrebbero non essere giustificate. Tuttavia, ci sono stati sistemi di rilascio di successo costruiti da nanoparticelle PLGA per il targeting cellulare specifico.Mentre l'efficacia dell'idrossiclorochina e dell'azitromicina nella prevenzione e nel trattamento della SARS-CoV-2 rimane un'area di studio attivo, gli esempi sopra servono a dimostrare che il tessuto ingegneri e scienziati di biomateriali hanno lavorato per decenni alla somministrazione di farmaci con una varietà di veicoli disponibili per piccole molecole in generale.
Oltre alle piccole molecole, gli anticorpi monoclonali sono una classe di farmaci entusiasmante, dato il loro successo nel trattamento del virus Ebola.Gli anticorpi sono una parte naturale dell'immunità umorale e possono essere progettati per bloccare specifici ligandi o recettori vitali per la funzione virale. Queste terapie generalmente devono essere somministrate per via endovenosa per avere successo. Negli studi sul virus Ebola, ad esempio, i pazienti hanno richiesto da una a tre sessioni di infusione, a seconda dell'anticorpo. Un anticorpo monoclonale umano è stato sviluppato contro SARS-CoV-1 e si è dimostrato efficace in un modello di furetto. I ricercatori hanno esaminato gli anticorpi monoclonali progettati contro SARS-CoV-1 e hanno scoperto la reattività crociata di almeno uno degli anticorpi contro SARS-CoV-2. I progetti di sistemi per il rilascio prolungato controllato di anticorpi possono essere vantaggiosi rispetto a più sessioni di infusione per la pratica clinica. Le impalcature nanoporose rivestite con polimero a base di allilammina erano in grado di rilasciare rituximab, un anticorpo monoclonale contro le cellule B, per un massimo di 30 giorni. Allo stesso modo, un sistema di somministrazione di farmaci a base di alginato è stato in grado di rilasciare un anticorpo monoclonale immunoglobulina umana G1 (IgG1) in un modello di ratto per almeno 28 giorni con una singola dose del sistema. Oltre alla possibilità di ridurre la somministrazione a dosaggio singolo mediante rilascio prolungato, sono stati sviluppati anche sistemi di iniezione ingeribili per rilasciare biomacromolecole attraverso l'autoiniezione durante il transito gastrico. Questi consentivano la somministrazione di insulina in un modello suino e possono facilitare la somministrazione orale di farmaci precedentemente efficaci solo in forma endovenosa.
Infine, è stato esplorato anche l'RNA interferente corto (siRNA) sia come profilassi che come terapia per l'infezione da coronavirus. Per le sequenze specifiche per SARS-CoV-1, siRNA era efficace in un modello NHP, con conseguente diminuzione della carica virale e danno alveolare. Quattro dosi intranasali sono state necessarie per 5 giorni nei bracci di trattamento. I ricercatori hanno riferito di non utilizzare veicoli aggiuntivi per fornire il loro siRNA come la polietilenimina a causa della possibilità di infiammazione polmonare indotta dal vettore. Tuttavia, da allora nel campo sono stati sviluppati veicoli più complessi specificamente per l'uso polmonare, comprese nanoparticelle di silice mesoporosa e liposomi cationici. Man mano che vengono identificate sequenze di siRNA, anticorpi specifici e piccole molecole che mitigano in modo specifico SARS-CoV-2, gli ingegneri dei tessuti e gli scienziati dei biomateriali possono continuare il loro lavoro nella progettazione di veicoli per colpire in modo specifico ed esteso aree ad alta carica virale. Anche se questo lavoro potrebbe non giungere a buon fine durante l'attuale pandemia, questi veicoli potrebbero svolgere ruoli vitali durante le future epidemie virali.
Piattaforme vaccinali
La capacità di vaccinare contro specifici patogeni ha svolto un ruolo importante nella medicina preventiva nell'ultimo secolo. Esistono vaccini sia per i virus respiratori come l'Influenzavirus sia per i batteri come Streptococcus pneumoniae e Haemophilus influenzae. Mentre il successo dei vaccini virali respiratori varia di stagione in stagione, i dati suggeriscono che la vaccinazione antinfluenzale generalmente si traduce in una minore probabilità di complicanze, tra cui degenza in terapia intensiva, ventilazione meccanica ed esiti gravi, specialmente nei pazienti con comorbidità come la broncopneumopatia cronica ostruttiva. Sono già in corso i lavori per sviluppare vaccini efficaci contro la SARS-CoV-2 per prevenire le malattie e mitigarne la trasmissione.
Il successo della vaccinazione contro i patogeni si basa sulla presentazione di antigeni e sulla stimolazione di elementi specifici del sistema immunitario per costruire il riconoscimento e la memoria sia nei rami umorali che in quelli mediati dalle cellule. Con i progressi dell'immunologia, i biomateriali e l'ingegneria dei tessuti vengono sfruttati per suscitare risposte immunitarie specifiche dell'ospite per aumentare le strategie di vaccinazione. In molti di questi sistemi, il biomateriale funge da veicolo di somministrazione del farmaco per il vaccino e come adiuvante. Inoltre, il campo sta caratterizzando il modo in cui le dimensioni, la forma e altre proprietà fisico-chimiche dei biomateriali influenzano il comportamento delle cellule immunitarie. Gli obiettivi di molti di questi sistemi sono di colpire le cellule che presentano l'antigene come i macrofagi e le cellule dendritiche e di guidare risposte specifiche come Th1 o Th2 (diverse classi T helper). Ad esempio, la coniugazione di diversi recettori a particelle a base di proteine può regolare individualmente la risposta Th1 o Th2 in un modello murino. Sono stati anche esplorati polimeri biodegradabili, uno dei principali cavalli di battaglia come materiale da impalcatura nell'ingegneria dei tessuti. Le nanoparticelle PLGA guidano la risposta immunitaria Th1 rispetto a nessun vettore e altri biomateriali in un vaccino contro la malattia di Chagas in un modello murino e sono state anche esplorate per il rilascio mirato a popolazioni immunitarie specifiche. Le microparticelle PLGA in combinazione con un rivestimento coniugato chitosano / peptide sono state utilizzate anche come sistema di rilascio per mirare a specifiche cellule della mucosa e per fornire un vaccino contro la dissenteria suina con elevata produzione di IgA e IgG nei topi. In un altro modello murino, le nanoparticelle di chitosano hanno migliorato la risposta dei linfociti T per un vaccino a DNA del Mycobacterium tuberculosis. Quando il chitosano è stato mannosilato per promuovere l'endocitosi, un vaccino intranasale ha aumentato i livelli di IgG in un modello murino. Per l'influenza, il chitosano è stato anche modificato per creare un vaccino murino intranasale termoresistente contro l'H5N1l. Le nanoparticelle d'argento sono state anche utilizzate per somministrare localmente il vaccino antinfluenzale inattivato con una certa specificità per le cellule immunitarie polmonari, con conseguente aumento dei titoli di IgG e riduzione della mortalità in un modello murino. Sebbene attualmente ci siano meno studi sui vaccini contro il coronavirus, c'è stato un certo successo nei topi in cui le nanoparticelle sono state preparate da una sequenza di peptidi SARS-CoV-1 e i sieri successivi hanno avuto successo nel prevenire l'infezione delle cellule Vero.
Oltre a varie piattaforme basate su particelle, sono state sfruttate strategie di ingegneria dei tessuti per creare sistemi di impalcature per il miglioramento della vaccinazione. Con proprietà fisico-chimiche specifiche, come la dimensione dei pori e il profilo dei segnali di reclutamento rilasciati come il fattore stimolante le colonie di granulociti, impalcature di PLGA e bacchette di silice mesoporose sono stati utilizzati per reclutare e concentrare le cellule che presentano l'antigene ai componenti del vaccino. Questa strategia è stata applicata principalmente ai vaccini antitumorali e ha dimostrato efficacia in modelli animali contro il melanoma e gliomi intracranici. È attualmente sottoposto a uno studio clinico di fase I su 23 pazienti con melanoma, che si stima sarà completato nel giugno 2020 (NCT01753089; ClinicalTrials.gov). Questa piattaforma di vaccinazione basata su impalcatura ha anche dimostrato l'efficacia contro i patogeni batterici nei modelli suini e murini. Altri esempi di sistemi di vaccini basati su impalcatura includono quelli generati dal virus respiratorio sinciziale che erano efficaci anche nei topi e nei NHP. Questi sistemi di vaccini basati su particelle e impalcature possono essere promettenti in traduzione contro SARS-CoV-2. Tuttavia, la maggior parte è stata studiata solo su modelli murini in questo momento e sarà necessario intraprendere sforzi traslazionali significativi per gli studi clinici. Le piattaforme modulari in cui possono essere inseriti diversi antigeni possono essere molto utili per lo sviluppo rapido di vaccini in future pandemie.
Conclusione
Il mondo deve affrontare una crisi sanitaria globale di portata mai vista. Il tasso di infezione e mortalità da COVID-19 lo rendono diverso da qualsiasi virus visto in questo secolo. Medici e scienziati si stanno unendo per combattere la minaccia di SAR-CoV-2. Gli ingegneri dei tessuti hanno una rara serie di strumenti e possono dare un contributo sostanziale alla nostra comprensione della malattia virale e contribuire allo sviluppo critico di piattaforme diagnostiche e terapeutiche. Insieme, possiamo superare questa attuale pandemia e lavorare per prevenire e mitigare future epidemie virali.
Da:



Commenti
Posta un commento