La regolazione della glicolisi e della gluconeogenesi / The regulation of glycolysis and gluconeogenesis
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
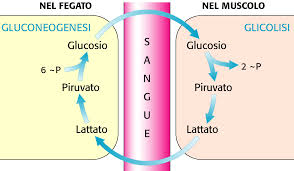
Nel fegato, glicolisi e gluconeogenesi sono
regolate in modo tale che, quando una via
è attiva, l’altra è quiescente, e viceversa.
L’enzima chiave della glicolisi è la fosfofruttocinasi mentre quello della gluconeogenesi è la
fruttosio 1,6-bisfosfatasi. Si tratta in entrambi
i casi di enzimi allosterici (figura 1).
Quando nel citoplasma sono presenti livelli elevati di AMP e ADP, a testimonianza
di un attivo consumo di ATP, significa che
la cellula è in uno stato di bassa carica energetica; ciò determina l’attivazione della glicolisi (h produzione di energia).
Al contrario, livelli elevati di ATP e citrato (una molecola che si forma nel mitocondrio quando il metabolismo ossidativo terminale è
attivo) indicano una condizione di elevata
carica energetica cellulare che determina
l’inibizione della glicolisi (g produzione di
energia).
Il citrato è la molecola che spiega l’effetto Pasteur, un importante fenomeno legato alla regolazione della glicolisi.
Nel corso dei suoi studi sulle fermentazioni nella
seconda metà del diciannovesimo secolo,
Louis Pasteur, illustre chimico francese, osservò che il consumo di glucosio in presenza di ossigeno diminuiva rispetto a quello registrato in condizioni anaerobie.
Pasteur propose che l’ossigeno stesso esercitasse una sorta di inibizione sulla glicolisi.
In realtà, l’ossigeno attiva la respirazione
cellulare che, a parità di glucosio consumato nella glicolisi, libera una quantità di
energia, anche in termini di molecole di ATP
prodotte, nettamente superiore a quella liberata in condizioni anaerobie.
Pertanto, in
presenza di ossigeno nel mitocondrio si producono notevoli quantità di citrato che, spostandosi nel citoplasma, inibiscono l’enzima fosfofruttocinasi e quindi la glicolisi.
La gluconeogenesi nel fegato viene regolata in modo opposto rispetto alla glicolisi.
Gli effettori allosterici positivi della glicolisi inibiscono la fruttosio 1,6-bisfosfatasi e pertanto rallentano la gluconeogenesi; al contrario, gli effettori allosterici negativi della glicolisi attivano la gluconeogenesi.
In tal modo viene sempre rispettato il principio della massima economia che
consente alla cellula di rispondere in maniera ottimale alle proprie esigenze energetiche.
Glicolisi e gluconeogenesi subiscono anche una regolazione di tipo ormonale mediata dalla molecola fruttosio 2,6-bisfosfato, il più potente effettore allosterico positivo della fosfofruttocinasi e negativo della
fruttosio 1,6-bisfosfatasi.
Questa molecola
è prodotta nella reazione catalizzata dalla
fosfofruttocinasi di tipo 2 (da non confondere con l’enzima glicolitico, detto anche
fosfofruttocinasi di tipo 1) ed è demolita nella reazione catalizzata dalla fruttosio 2,6-
bisfosfatasi (un’attività enzimatica diversa
da quella riconducibile all’enzima che partecipa alla gluconeogenesi).
Queste due attività enzimatiche sono contenute nella stessa molecola. Si tratta quindi di un enzima bifunzionale che, in quanto dotato di due siti attivi, catalizza due reazioni opposte; per tale motivo questa molecola è nota anche come enzima tandem
CH2OPO3
2–
H OH
OP
Figura 1 Regolazione degli enzimi chiave di glicolisi (a sinistra) e gluconeogenesi (a destra). / Regulation of the key enzymes of glycolysis (left) and gluconeogenesis (right).
Le due attività enzimatiche si
escludono mutuamente: infatti la regolazione dell’enzima è tale che quando un sito
attivo funziona l’altro è inattivo e viceversa.
Il fattore che determina il funzionamento dell’enzima tandem come fosfofruttocinasi di tipo 2 oppure come fruttosio 2,6-bisfosfatasi è lo stato di fosforilazione dell’enzima stesso:
• L’enzima tandem fosforilato funziona
come fruttosio 2,6-bisfosfatasi avendo
inibita l’attività cinasica.
• L’enzima tandem non fosforilato agisce
come fosfofruttocinasi di tipo 2 avendo
inibita l’attività fosfatasica.
Figura 2
Figura 2 Struttura
dell’enzima tandem / Structure of the tandem enzyme
La fosforilazione dell’enzima tandem è catalizzata da una proteina cinasi cAMP-dipendente, un enzima che si attiva sotto stimolo del glucagone.
Il glucagone quindi
determina il funzionamento dell’enzima
tandem come fruttosio 2,6-bisfosfatasi. Ciò
provoca l’idrolisi del fruttosio 2,6-bisfosfato la cui concentrazione diminuisce, facendo venir meno lo stimolo sull’enzima
chiave della glicolisi e, allo stesso tempo,
l’inibizione su quello della gluconeogenesi.
Per effetto di queste modificazioni, le
cellule epatiche producono glucosio che
immettono in circolo; ciò spiega l’effetto
iperglicemizzante del glucagone.
La defosforilazione dell’enzima tandem
è catalizzata da una fosfoproteina fosfatasi
che si attiva sotto stimolo dell’insulina, un
altro ormone.
L’insulina determina quindi
il funzionamento dell’enzima tandem come
fosfofruttocinasi di tipo 2.
Ciò provoca la
sintesi del fruttosio 2,6-bisfosfato, la cui concentrazione aumenta, stimolando l’enzima
chiave della glicolisi e al contempo inibendo quello della gluconeogenesi.
In queste
condizioni l’attivazione della glicolisi nelle
cellule epatiche (ma anche nelle altre cellule dell’organismo) aumenta il consumo
di glucosio, che viene drenato dal circolo;
ciò spiega l’effetto ipoglicemizzante dell’insulina.
La figura 3 riassume la regolazione ormonale delle due vie metaboliche.
Figura 3 Controllo ormonale dei livelli di fruttosio 2,6-bisfosfato. / Hormonal control of fructose 2,6-bisphosphate levels.
ENGLISH
In the liver, glycolysis and gluconeogenesis are regulated in such a way that, when one pathway is active, the other is quiescent, and vice versa.
The key enzyme of glycolysis is phosphofructokinase while that of gluconeogenesis is fructose 1,6-bisphosphatase. In both cases, these are allosteric enzymes (figure 1).
When high levels of AMP and ADP are present in the cytoplasm, reflecting an active consumption of ATP, it means that the cell is in a state of low energy charge; this determines the activation of glycolysis (h energy production).
On the contrary, high levels of ATP and citrate (a molecule that forms in the mitochondrion when the terminal oxidative metabolism is active) indicate a condition of high cellular energy charge that determines the inhibition of glycolysis (g energy production).
Citrate is the molecule that explains the Pasteur effect, an important phenomenon linked to the regulation of glycolysis.
In the course of his studies on fermentation in the second half of the nineteenth century, Louis Pasteur, a famous French chemist, observed that the consumption of glucose in the presence of oxygen decreased compared to that recorded in anaerobic conditions.
Pasteur proposed that oxygen itself exerted a sort of inhibition on glycolysis.
In fact, oxygen activates cellular respiration which, for the same amount of glucose consumed in glycolysis, releases an amount of energy, also in terms of ATP molecules produced, much higher than that released in anaerobic conditions.
Therefore, in the presence of oxygen in the mitochondrion, large quantities of citrate are produced which, moving into the cytoplasm, inhibit the enzyme phosphofruttokinase and therefore glycolysis.
Gluconeogenesis in the liver is regulated in the opposite way to glycolysis.
The positive allosteric effectors of glycolysis inhibit fructose 1,6-bisphosphatase and therefore slow down gluconeogenesis; on the contrary, the negative allosteric effectors of glycolysis activate gluconeogenesis.
In this way, the principle of maximum economy is always respected, which allows the cell to respond optimally to its energy needs.
Glycolysis and gluconeogenesis also undergo hormonal regulation mediated by the fructose 2,6-bisphosphate molecule, the most potent allosteric effector positive of phosphofructokinase and negative of fructose 1,6-bisphosphatase.
This molecule is produced in the reaction catalyzed by phosphofructokinase type 2 (not to be confused with the glycolytic enzyme, also called phosphofructokinase type 1) and is broken down in the reaction catalyzed by fructose 2,6-bisphosphatase (an enzymatic activity other than attributable to the enzyme that participates in gluconeogenesis).
These two enzymatic activities are contained in the same molecule.
It is therefore a bifunctional enzyme which, as it has two active sites, catalyzes two opposite reactions; for this reason this molecule is also known as a tandem enzyme CH2OPO3 2– H OH OP
The two enzymatic activities are mutually exclusive: in fact, the regulation of the enzyme is such that when one active site works, the other is inactive and vice versa.
The factor that determines the functioning of the tandem enzyme as type 2 phosphofructokinase or as fructose 2,6-bisphosphatase is the phosphorylation state of the enzyme itself:
• The phosphorylated tandem enzyme functions as fructose 2,6-bisphosphatase having inhibited the kinase activity.
• The non-phosphorylated tandem enzyme acts as type 2 phosphofruttokinase having inhibited the phosphatase activity. Figure 2
The phosphorylation of the tandem enzyme is catalyzed by a cAMP-dependent protein kinase, an enzyme that is activated under the stimulus of glucagon.
Glucagon therefore determines the functioning of the tandem enzyme as fructose 2,6-bisphosphatase. This causes the hydrolysis of fructose 2,6-bisphosphate, the concentration of which decreases, eliminating the stimulus on the key enzyme of glycolysis and, at the same time, inhibiting that of gluconeogenesis.
As a result of these modifications, the liver cells produce glucose which they release into the circulation; this explains the hyperglycemic effect of glucagon.
The dephosphorylation of the tandem enzyme is catalyzed by a phosphoprotein phosphatase which is activated under the stimulus of insulin, another hormone.
Insulin therefore determines the functioning of the tandem enzyme as type 2 phosphofruttokinase.
This causes the synthesis of fructose 2,6-bisphosphate, whose concentration increases, stimulating the key enzyme of glycolysis and at the same time inhibiting that of gluconeogenesis.
In these conditions, the activation of glycolysis in the liver cells (but also in the other cells of the body) increases the consumption of glucose, which is drained from the circulation; this explains the hypoglycemic effect of insulin.
Figure 3 summarizes the hormonal regulation of the two metabolic pathways.
Da:
https://online.scuola.zanichelli.it/percorsibiochimica/files/2011/12/Scheda0703_StefaniTaddei.pdf






Commenti
Posta un commento