The Molecular Structure of Antibodies / La struttura molecolare degli anticorpi
The Molecular Structure of Antibodies / La struttura molecolare degli anticorpi
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
This
knowledge fuels the modern engineering of antibody and antibody-related
therapeutics with the desired antigen affinity, effector function, mechanism
of action, and biophysical properties.
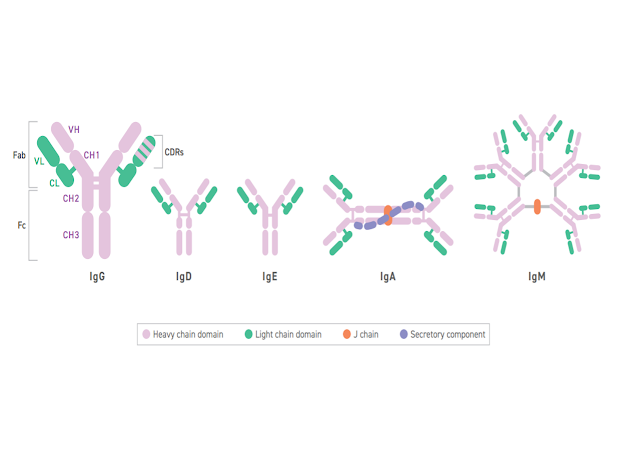
TAILS AND ARMS
In simple terms, antibodies are Y-shaped quaternary proteins.
The base
or “tail” is called the fragment crystallizable (Fc) region.
The two “arms”
extending outwards are known as the fragment antigen-binding (Fab)
region.
At the very tip of each arm is the paratope, which allows the
antibody to bind a specific antigen epitope via the complementarity
determining regions or CDRs.
HEAVY AND LIGHT CHAINS
Zooming in, the critical Fragment Antigen Binding domains, e.g. Fab
regions, comprise four polypeptide chains; two identical light chains and
two identical heavy chains.
Both light and heavy chains have a constant
region and a variable region.
As the names suggest, the constant
region remains the same across all antibodies in a given isotype.
The
variable region, also known as Fv, differs from antibody to antibody
(unless they’re produced by a single B cell or B cell clone).
HYPERVARIABLE REGIONS
Complementarity-determining regions (CDRs; see image above) are responsible for most of the sequence variation that occurs
in antibodies and, in turn, the impressive scope these proteins have for
binding different antigens.
For this reason, they are also referred to as
hypervariable regions.
Each of the four peptide chains (heavy and light)
have three CDRs on their variable domains, for a total of 12 per IgG
antibody (see above)
ANTIBODY CLASSES
Heavy chains also determine which of the main classes or isotypes
the antibody fits into. In humans, there are five known isotypes: IgA,
IgD, IgE, IgG, and IgM.
Each has a distinct role, with different binding
characteristics and distinct biological properties.
In the world of
therapeutics, the vast majority of monoclonal antibodies and Fc fusion
proteins are part of the IgG class, which has four different subclasses
within it namely, IgG1, IgG2, IgG3 and IgG4.
ITALIANO
Il successo degli anticorpi monoclonali come classe terapeutica non sarebbe possibile senza una forte comprensione della struttura degli anticorpi.
Questa conoscenza alimenta la moderna ingegneria degli anticorpi e delle terapie correlate agli anticorpi con l'affinità antigenica, la funzione effettrice, il meccanismo d'azione e le proprietà biofisiche desiderati.
CODA E BRACCI
In termini semplici, gli anticorpi sono proteine quaternarie a forma di Y.
La base o "coda" è chiamata regione cristallizzabile del frammento (Fc).
I due "braccia" che si estendono verso l'esterno sono noti come regione legante l'antigene del frammento (Fab).
All'estremità di ciascun braccio si trova il paratopo, che consente all'anticorpo di legare un epitopo antigenico specifico tramite le regioni che determinano la complementarità o CDR.
CATENE PESANTI E LEGGERE
Ingrandendo, i domini critici di legame dell'antigene del frammento, ad es. Le regioni Fab, comprendono quattro catene polipeptidiche; due catene leggere identiche e due catene pesanti identiche.
Sia le catene leggere che quelle pesanti hanno una regione costante e una regione variabile.
Come suggeriscono i nomi, la regione costante rimane la stessa per tutti gli anticorpi in un dato isotipo.
La regione variabile, nota anche come Fv, differisce da anticorpo ad anticorpo (a meno che non siano prodotti da una singola cellula B o da un clone di cellule B).
REGIONI IPERVARIABILI
Le regioni che determinano la complementarità (CDR; vedi immagine sopra) sono responsabili della maggior parte della variazione di sequenza che si verifica negli anticorpi e, a loro volta, dell'impressionante scopo che queste proteine hanno per legare diversi antigeni.
Per questo motivo vengono anche chiamate regioni ipervariabili.
Ognuna delle quattro catene peptidiche (pesante e leggera) ha tre CDR sui propri domini variabili, per un totale di 12 per anticorpo IgG (vedi sopra)
CLASSI DI ANTICORPI
Le catene pesanti determinano anche in quale delle principali classi o isotipi si inserisce l'anticorpo. Nell'uomo sono noti cinque isotipi: IgA, IgD, IgE, IgG e IgM.
Ognuno ha un ruolo distinto, con diverse caratteristiche di legame e distinte proprietà biologiche.
Nel mondo della terapia, la stragrande maggioranza degli anticorpi monoclonali e delle proteine di fusione Fc fanno parte della classe IgG, che ha al suo interno quattro diverse sottoclassi e cioè IgG1, IgG2, IgG3 e IgG4.
Da:
https://f.hubspotusercontent40.net/hubfs/547446/Technology%20Networks/Landing%20Pages/Twist%20Bio/May%202021/eBook_Biopharma_AntbodyDiscoveryandDev_02APRIL21_Rev1.0_0.pdf?__hstc=8807082.44b0f6eac84be5818378483b36bfad3b.1601170002551.1621382061009.1622335921752.112&__hssc=8807082.2.1622335921752&__hsfp=2281083568&hsCtaTracking=ab6385e9-0a38-4af4-8bcb-bcc4108a5a59%7C5e7e8d79-eaee-44f7-a75d-3d5a2a4f479e



Commenti
Posta un commento