INNOVATIVE IMMUNOASSAY SOLUTIONS FOR AUTOPHAGY RESEARCH / SOLUZIONI DI IMMUNODOSAGGIO INNOVATIVE PER LA RICERCA DELL'AUTOFAGIA
INNOVATIVE IMMUNOASSAY SOLUTIONS FOR AUTOPHAGY RESEARCH / SOLUZIONI DI IMMUNODOSAGGIO INNOVATIVE PER LA RICERCA DELL'AUTOFAGIA
Segnalato dal Dott. Giuseppe Cotellessa / Reported by Dr. Giuseppe Cotellessa
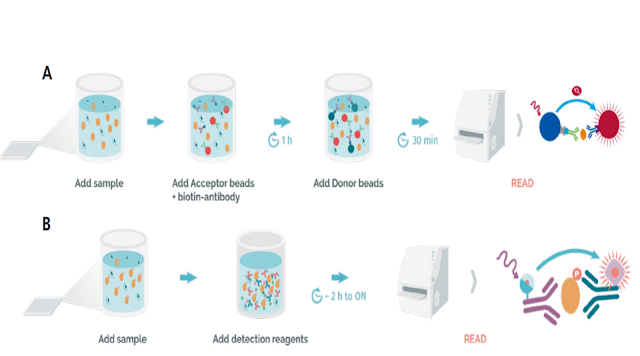
Figure 1: A) The AlphaLISA workflow. B) The HTRF workflow / A) Il flusso di lavoro AlphaLISA. B) Il flusso di lavoro HTRF
Immunoassays are used to detect and quantify analytes from various complex samples containing an abundance of proteins and other molecules (e.g., blood, urine or human serum). They have become a fundamental part of scientific research and drug discovery since their introduction in the 1950’s. Although traditional immunoassay platforms such as western blots and enzyme-linked immunosorbent assays (ELISAs) are still commonplace throughout research, they are often time- and resource-intensive, involve complex protocols and suffer from limited sensitivity, throughput and detectable range. PerkinElmer offers a range of ELISA alternative immunoassay technologies, pre-configured kits, and customizable reagents for superior results. From sample compatibility and sample volume, to throughput, reproducibility, automation compatibility, and desired speed of results, these solutions ensure optimal performance of your immunoassay platforms. This article will explore the features of the AlphaLISA and Homogenous Time Resolved Technology (HTRF) immunoassays and their role in autophagy research.
Alpha Technology
AlphaLISA® assays are homogenous, no-wash alternatives to ELISAs which enable a simple, streamlined workflow for the detection and quantification of biomolecules. They are beadbased luminescent amplification assays; therefore, they offer greater sensitivity, a wider dynamic range and require smaller sample sizes (~5 µL) compared to traditional ELISAs. Their versatility enables them to detect intracellular and/or membrane-bound analytes, as well as those that are secreted. As shown in Figure 1A, a biotinylated antibody and an antibody-conjugated AlphaLISA acceptor bead are used to capture the target analyte. After one-hour, the Alpha streptavidin-coated donor bead is added, and the sample is incubated for a further 30-60 minutes. When the analyte is present in the sample, the donor and acceptor beads are brought together. Upon excitation, a photosensitizer inside the donor bead converts ambient oxygen to an excited singlet state. Singlet oxygen diffuses up to 200 nm to produce a chemiluminescent reaction in the acceptor bead, resulting in the emission of light – which is proportional to the amount of analyte present in the sample. In the AlphaLISA assay, the acceptor beads, anthracene, and rubrene are substituted with an Europium (Eu) chelate. This is directly excited by the 340 nm light resulting from the conversion of thioxene to a di-ketone derivative following its reaction with singlet oxygen. Excited Eu chelate generates an intense light detectable within a narrow wavelength bandwidth centered around 615 nm. The AlphaLISA emission is therefore less susceptible to interference by either artificial or natural compounds, such as hemoglobin, which absorb light between 500-600 nm.
Homogenous Time Resolved Fluorescence Technology
HTRF is a no-wash technology that combines standard fluorescence resonance energy transfer (FRET) technology with time-resolved measurements of fluorescence. Traditional FRET technologies are limited by background fluorescence from sample components (e.g., buffers, proteins, chemical compounds and cell lysates), however this can be eliminated using time-resolved methods. Much like Alpha technology, the HTRF protocol is straightforward, requiring only a few steps (Figure 1B). The anti-analyte conjugated antibodies carrying the donor and acceptor fluorophores are added to the sample. Following two hours of incubation, the detection takes place on an HTRF compatible microplate reader. If the two antibodies recognize the analyte, the donor will emit a fluorescence signal upon excitation and the energy will be transferred to the nearby acceptor, giving specific acceptor fluorescence. The light emitted by the acceptor is proportional to the level of interaction.
Immunoassays for Every Need
PerkinElmer’s immunoassay solutions are expanding research possibilities for a growing number of applications. This section will explore their role in autophagy research in more detail .
Detecting general mechanisms of autophagy
Lysosomal dysregulation is implicated in many neurodegenerative diseases, including aging. Tracking proteins associated with the lysosome therefore allows researchers to investigate the mechanisms of autophagy. Sequestosome-1, also known as p62, is incorporated into autophagosomes before degradation in the final steps of autophagy. Visualizing p62 puncta helps to determine a block or increased flux in autophagy, however traditional methods are time-intensive, have a low throughput and require specialized equipment. The homogeneous no-wash AlphaLISA®p62 assay accurately quantify p62 expression levels during autophagy with and without treatment with chloroquine, a common inhibitor of autophagy. The AlphaLISA p62 assay has a large dynamic range, is adaptable to various cell types and can provide quantitative p62 data faster than immunofluorescent staining.
Huntington’s Disease
The HTT gene contains a repeat of CAG codon coding for glutamine. When the gene contains 40 or more repeats, the resulting mutation (mHTT) produces an altered protein that leads to neuronal death. High levels of mHTT correlate with the development of Huntington’s Disease (HD), therefore, lowering soluble mHTT may provide an effective approach to treat HD by ameliorating downstream toxicity. In this context, several drug discovery strategies have been investigated to treat HD by lowering the levels of mHTT. For example, Li et al. investigated if compounds targeting both the mHTT and the autophagosome protein microtubule-associated protein 1A/1B light chain 3 (LC3) can reduce the levels of the mutant protein. Using HTRF, they found four compounds that were able to bind both proteins and reduce mHTT levels by inducing autophagy clearance of mHTT.1 These results showed that modulation of the autophagy pathway may represent a new paradigm for treating HD. Moreover, the therapeutic effect of the active compounds found in this study could also be extended to treat other poly-Q diseases.
Conclusion
Western blots and ELISAs have traditionally been the preferred assays for research and drug discovery workflows. However, the solutions offered by PerkinElmer provide several advantages over these technologies, including ease of use and scalability, without compromising on sensitivity and specificity. HTRF technology can be used in competitive and non-competitive formats or performed as cellular or biochemical assays. As a result, it can be used in a variety of applications including GPCRs, kinases, epigenetics, and quantification of a range of biomarkers including cytokines. Similarly, Alpha technology is compatible with a wide range of sample types ranging from simple buffers, cell supernatants, and cell lysates to complex tissue, serum, plasma, and other biological samples.
ITALIANO
I test immunologici vengono utilizzati per rilevare e quantificare analiti da vari campioni complessi contenenti un'abbondanza di proteine ed altre molecole (ad es. sangue, urina o siero umano). Sono diventati una parte fondamentale della ricerca scientifica e della scoperta di farmaci sin dalla loro introduzione negli anni '50. Sebbene le tradizionali piattaforme di test immunologico come western blot e test di immunoassorbimento enzimatico (ELISA) siano ancora comuni nel corso della ricerca, spesso richiedono tempo e risorse, coinvolgono protocolli complessi e soffrono di sensibilità, throughput e range rilevabile limitati. PerkinElmer offre una gamma di tecnologie ELISA alternative per i test immunologici, kit preconfigurati e reagenti personalizzabili per risultati superiori. Dalla compatibilità del campione e dal volume del campione, alla produttività, alla riproducibilità, alla compatibilità dell'automazione e alla velocità dei risultati desiderata, queste soluzioni garantiscono prestazioni ottimali delle piattaforme di test immunologico. Questo articolo esplorerà le caratteristiche dei test immunologici AlphaLISA e Homogenous Time Resolved Technology (HTRF) ed il loro ruolo nella ricerca sull'autofagia.
Tecnologia alfa
I test AlphaLISA® sono alternative omogenee e senza lavaggio agli ELISA che consentono un flusso di lavoro semplice e ottimizzato per il rilevamento e la quantificazione delle biomolecole. Sono saggi di amplificazione luminescente a base di microsfere; pertanto, offrono una maggiore sensibilità, una gamma dinamica più ampia e richiedono campioni di dimensioni inferiori (~5 µL) rispetto ai tradizionali ELISA. La loro versatilità consente loro di rilevare analiti intracellulari e/o legati alla membrana, nonché quelli secreti. Come mostrato nella Figura 1A, per catturare l'analita bersaglio vengono utilizzati un anticorpo biotinilato ed una perla accettore AlphaLISA coniugata con anticorpi. Dopo un'ora, viene aggiunta la perlina donatrice rivestita di streptavidina alfa e il campione viene incubato per altri 30-60 minuti. Quando l'analita è presente nel campione, i granuli di donatore e accettore vengono riuniti. Dopo l'eccitazione, un fotosensibilizzante all'interno del tallone del donatore converte l'ossigeno ambientale in uno stato di singoletto eccitato. L'ossigeno singoletto diffonde fino a 200 nm per produrre una reazione chemiluminescente nel tallone accettore, con conseguente emissione di luce, che è proporzionale alla quantità di analita presente nel campione. Nel test AlphaLISA, i granuli accettori, l'antracene e il rubrene vengono sostituiti con un chelato Europio (Eu). Questo è eccitato direttamente dalla luce a 340 nm risultante dalla conversione del tioxene in un derivato dichetone dopo la sua reazione con l'ossigeno singoletto. Il chelato di Eu eccitato genera una luce intensa rilevabile all'interno di una larghezza di banda di lunghezza d'onda stretta centrata intorno a 615 nm. L'emissione di AlphaLISA è quindi meno suscettibile all'interferenza di composti artificiali o naturali, come l'emoglobina, che assorbono la luce tra 500-600 nm.
Tecnologia di fluorescenza omogenea risolta nel tempo
HTRF è una tecnologia no-wash che combina la tecnologia standard di trasferimento di energia di risonanza della fluorescenza (FRET) con misurazioni della fluorescenza risolte nel tempo. Le tradizionali tecnologie FRET sono limitate dalla fluorescenza di fondo dei componenti del campione (ad esempio, tamponi, proteine, composti chimici e lisati cellulari), tuttavia questa può essere eliminata utilizzando metodi risolti nel tempo. Proprio come la tecnologia Alpha, il protocollo HTRF è semplice e richiede solo pochi passaggi (Figura 1B). Gli anticorpi coniugati anti-analita che trasportano i fluorofori donatori e accettori vengono aggiunti al campione. Dopo due ore di incubazione, il rilevamento avviene su un lettore di micropiastre compatibile con HTRF. Se i due anticorpi riconoscono l'analita, il donatore emetterà un segnale di fluorescenza dopo l'eccitazione e l'energia verrà trasferita all'accettore vicino, dando una fluorescenza specifica dell'accettore. La luce emessa dall'accettore è proporzionale al livello di interazione.
Saggi immunologici per ogni esigenza
Le soluzioni di test immunologico di PerkinElmer stanno ampliando le possibilità di ricerca per un numero crescente di applicazioni. Questa sezione esplorerà il loro ruolo nella ricerca sull'autofagia in modo più dettagliato.
Rilevazione dei meccanismi generali dell'autofagia
La disregolazione lisosomiale è implicata in molte malattie neurodegenerative, compreso l'invecchiamento. Il monitoraggio delle proteine associate al lisosoma consente quindi ai ricercatori di studiare i meccanismi dell'autofagia. Il sequestosoma-1, noto anche come p62, è incorporato negli autofagosomi prima della degradazione nelle fasi finali dell'autofagia. La visualizzazione di p62 puncta aiuta a determinare un blocco o un aumento del flusso nell'autofagia, tuttavia i metodi tradizionali richiedono molto tempo, hanno una bassa produttività e richiedono attrezzature specializzate. Il dosaggio omogeneo no-wash AlphaLISA®p62 quantifica accuratamente i livelli di espressione di p62 durante l'autofagia con e senza trattamento con clorochina, un comune inibitore dell'autofagia. Il test AlphaLISA p62 ha un'ampia gamma dinamica, è adattabile a vari tipi di cellule e può fornire dati quantitativi sulla p62 più velocemente rispetto alla colorazione immunofluorescente.
Malattia di Huntington
Il gene HTT contiene una ripetizione del codone CAG che codifica per la glutammina. Quando il gene contiene 40 o più ripetizioni, la mutazione risultante (mHTT) produce una proteina alterata che porta alla morte neuronale. Alti livelli di mHTT sono correlati allo sviluppo della malattia di Huntington (HD), pertanto, la riduzione dell'mHTT solubile può fornire un approccio efficace per trattare l'HD migliorando la tossicità a valle. In questo contesto, sono state studiate diverse strategie di scoperta di farmaci per trattare la MH abbassando i livelli di mHTT. Ad esempio, Li et al. hanno studiato se i composti che prendono di mira sia l'mHTT che la catena leggera 3 (LC3) della proteina 1A/1B associata ai microtubuli della proteina autofagosoma possono ridurre i livelli della proteina mutante. Utilizzando HTRF, hanno trovato quattro composti in grado di legare entrambe le proteine e ridurre i livelli di mHTT inducendo la clearance dell'autofagia di mHTT.1 Questi risultati hanno mostrato che la modulazione del percorso dell'autofagia può rappresentare un nuovo paradigma per il trattamento della MH. Inoltre, l'effetto terapeutico dei composti attivi trovati in questo studio potrebbe essere esteso anche al trattamento di altre malattie poli-Q.
Conclusione
I western blot e gli ELISA sono stati tradizionalmente i test preferiti per i flussi di lavoro di ricerca e scoperta di farmaci. Tuttavia, le soluzioni offerte da PerkinElmer offrono numerosi vantaggi rispetto a queste tecnologie, tra cui facilità d'uso e scalabilità, senza compromettere la sensibilità e la specificità. La tecnologia HTRF può essere utilizzata in formati competitivi e non competitivi od eseguita come test cellulari o biochimici. Di conseguenza, può essere utilizzato in una varietà di applicazioni tra cui GPCR, chinasi, epigenetica e quantificazione di una gamma di biomarcatori comprese le citochine. Allo stesso modo, la tecnologia Alpha è compatibile con un'ampia gamma di tipi di campioni che vanno da semplici tamponi, supernatanti cellulari e lisati cellulari a tessuti complessi, siero, plasma e altri campioni biologici.
Da:
https://547446.fs1.hubspotusercontent-na1.net/hubfs/547446/Technology%20Networks/TN%20Email%20Campaigns%20and%20App%20Alerts/Landing%20Page%20Promotions/TN_PerkinElmer_Autophagy_eBOOK.pdf?__hstc=8807082.074aceb79027e793890018c0152531d2.1643566337753.1660566950782.1661004111073.98&__hssc=8807082.1.1661004111073&__hsfp=1418904915&hsCtaTracking=08f36d5a-c178-4aaa-8546-e0e9b7d49144%7C06cccf51-b0ee-45fd-8f4a-06040bf42e95



Commenti
Posta un commento